В различных клеточных популяциях
| Вид материала | Документы |
- Аннотация рабочей программы дисциплины основы клеточных технологий цель дисциплины, 48.85kb.
- Сухачев александр Николаевич динамика клеточных популяций гемоцитов асцидии, 331.84kb.
- Социального развития российской федерации иммунореабилитация при инфекционно-воспалительных, 1443.13kb.
- Молекулярно-генетические и клинико-генотипические особенности муковисцидоза в российских, 924.89kb.
- Мутации и мутационный процесс в природных популяциях, 723.69kb.
- Курсовые работы на конкурс (21 мая 2009, ауд. 1-42), 85.51kb.
- М. В. Ломоносова биологический факультет кафедра антропологии Реферат, 448.61kb.
- Программа по «Экологии и природопользованию», 197.56kb.
- Физиология клеточных процесов, 79.34kb.
- «временное», 130.85kb.
На правах рукописи
ФЛЕЙШМАН
Марина Юрьевна
МОРФОГЕНЕТИЧЕСКАЯ
АКТИВНОСТЬ ДЕРМОРФИНА И ЕГО АНАЛОГОВ
В РАЗЛИЧНЫХ КЛЕТОЧНЫХ ПОПУЛЯЦИЯХ
03.03.04 – клеточная биология, цитология, гистология
Автореферат
диссертации на соискание ученой степени
доктора медицинских наук
Владивосток
2010
Работа выполнена в Центральной научно-исследовательской
лаборатории ГОУ ВПО «Дальневосточный государственный
медицинский университет Росздрава»
Научный консультант: заслуженный деятель науки РФ,
доктор медицинских наук, профессор
Тимошин Сергей Серафимович
Официальные оппоненты: доктор медицинских наук, профессор
Склянов Юрий Иванович
ГОУ ВПО «Новосибирский государственный
медицинский университет Росздрава»
доктор биологических наук
Вараксин Анатолий Алексеевич
ГУ Институт биологии моря, г. Владивосток
доктор медицинских наук, профессор
Елисеева Екатерина Валерьевна
ГОУ ВПО «Владивостокский государственный
медицинский университет Росздрава»
Ведущая организация: ГУ НИИ морфологии человека РАМН
(г. Москва)
Защита диссертации состоится 22 октября 2010 года
в «___» часов на заседании диссертационного совета Д 208.007.01 при ГОУ ВПО «Владивостокский государственный медицинский университет Росздрава» (690002, г. Владивосток, пр. Острякова, 2).
С диссертацией можно ознакомиться в библиотеке
Владивостокского государственного медицинского университета
по адресу: 690002, г. Владивосток, пр. Острякова, 2
Автореферат разослан «___»______________2010 года.
Ученый секретарь диссертационного совета
доктор медицинских наук, профессор Г.В. Рева
Общая характеристика работы
Актуальность проблемы
Регуляторные пептиды филогенетически самая древняя форма управления. Они обнаружены у прокариот и выявлены, фактически, во всех тканях млекопитающих. Это дало основание для положения, что, «все органы и ткани животных являются эндокринными и секретируют гормоны пептидной природы» (Панков Ю. А., 1996; 2005).
Семейство опиоидных пептидов наиболее многочисленное и самое изученное из представителей регуляторных пептидов (Зайцев С. В. и соавт. 1993; Ашмарин И. П., 2005). Выделение эндогенных опиоидных пептидов изменило представление о функционировании регуляторных систем. Рецепторы опиоидных пептидов были идентифицированы в нейронах, в клетках иммунной и эндокринной систем, в клетках ЖКТ и др. Способность клеток интегративной системы секретировать различные регуляторные пептиды, а также наличие на них рецепторов к этим пептидам обеспечивает «закольцованность» интегративных систем в единый регуляторный континуум (Koroleva S. V., Ashmarin I. P., 2002, 2006).
Высокая физиологическая активность РП послужила толчком для создания на основе их химических аналогов фармакологических препаратов. Список подобных лекарств исчисляется сотнями (Oliver K.R. et al., 2000; Brain S.D., Cox H.M., 2006; Delgado M., Ganea D., 2008). Это в полной мере относится к опиоидным пептидам.
Дерморфины – особый класс семейства опиоидных пептидов. У всех природных дерморфинов присутствует N-концевая последовательность Tyr-D-Ala-Phe, в которой между двумя ароматическими кольцами Tyr и Phe расположен D-аминокислотный остаток аланина, что обусловливает специфику биологической активности дерморфинов. Устойчивость дерморфина к действию эндогенных пептидаз, а также уникальная анальгетическая активность, превышающая этот показатель у морфина на два порядка, послужили предпосылкой для создания синтетических аналогов дерморфина.
Изучение биологической активности пептидов выявило их адаптогенные свойства, способность влиять на терморегуляцию, сон и оказывать антиалкогольное воздействие (Громова Е.А. и соавт., 1989; Ярова Е.П., 1990; Ковальзон В.М. и соавт., 2002; Емельянова Т.Г. и соавт., 2007; Reddy P. A. et al., 2009). В наших предыдущих исследованиях было установлено, что дерморфин и его аналоги вовлечены в регуляцию процессов клеточного деления.
Одна из тенденций современных фундаментальных исследований в биологии направлена на получение предпосылок к созданию на основе исследуемых эндогенных регуляторов фармакологических препаратов. В настоящее время на базе одного из аналогов дерморфина – седатина (H-Arg-Tyr-D-Ala-Phe-Gly-OH), создается лекарственная форма. Препарат является официнальным в ветеринарии и готовится к клиническим испытаниям. Поэтому всестороннее изучение его влияния на различные цитофизиологические процессы имеет прикладное значение.
На момент начала настоящей работы оставались неизученными такие важные аспекты влияния дерморфинов, как участие в поддержании тканевого гомеостаза в условиях патологии, в частности, при НПВП-гастропатии. Неизвестны механизмы, посредством которых дерморфины реализуют свое цитопротективное действие в этих условиях. Ранее нами было изучено влияние дерморфинов на процессы пролиферации у крыс.
Вопрос о способности влияния представителей этого семейства опиатов на процессы регенерации у других представителей типа хордовых, в частности, у рыб, отсутствует. Не исследовалось влияние дерморфинов на ранние этапы онтогенеза и возможные долгосрочные эффекты аналогов дермофина.
Отсутствовали сведения о вовлеченности дерморфина и его аналогов в регуляцию процессов свободнорадикального окисления. В последние годы имеет место переосмысливание представлений о свободнорадикальном окислении, как важном факторе патогенеза и регуляции, в том числе, процессов клеточного деления.
Цель настоящего исследования:
Изучить влияние дерморфина и его аналогов на состояние тканевого гомеостаза в различных клеточных популяциях.
Задачи исследования:
Изучить характер влияния дерморфина и его аналогов, обладающих различным сродством к мю- и дельта- рецепторам, на процессы синтеза ДНК в различных клеточных популяциях.
- Изучить характер влияния дерморфина и его аналогов на процессы синтеза ДНК при непосредственном воздействии (аппликации на роговицу и введении в культуру дермальных фибробластов).
- Изучить характер влияния различных доз аргининсодержащего аналога дерморфина – седатина на процессы синтеза ДНК в эпителии слизистой оболочки желудка и роговицы белых крыс.
- Изучить характер влияния аналогов дерморфина на процессы синтеза ДНК в СОЖ при НПВП-гастропатии.
- Изучить механизмы цитопротективного действия седатина при НПВП-гастропатии.
- Изучить характер влияния аналогов дерморфина на процессы морфогенеза осетровых рыб и оценить возможность отдаленных эффектов при обработке оплодотворенной икры пептидами.
- Изучить возможность использования аналогов дерморфина для оптимизации процессов разведения осетровых рыб.
Научная новизна:
Впервые установлена способность седатина стимулировать процессы синтеза ДНК в эпителии желудка в широком диапазоне доз.
Впервые установлена способность седатина осуществлять протективный эффект при нарушении целостности СОЖ, индуцированном производными ацетилсалициловой кислоты.
Впервые установлено участие системы Arg-NOS в протективном эффекте седатина при НПВП-гастропатии.
Впервые установлено, что обработка оплодотворенной икры осетровых рыб седатином оптимизирует процессы развития осетровых рыб.
Впервые разработан метод использования седатина для оптимизации процессов разведения осетровых рыб.
Практическая значимость:
- Установленная нами способность седатина – потенциального фармакологического препарата – оказывать цитопротективные эффекты при НПВП-гастропатии, может быть использована в клинической практике для профилактики нарушений целостности СОЖ при приеме нестероидных противовоспалительных препаратов.
- Разработанный нами метод оптимизации разведения осетровых рыб используется на рыборазводных предприятиях Дальнего Востока.
- Обнаруженные нами закономерности влияния аналогов дерморфина на процессы синтеза ДНК в норме и при патологии могут быть использованы при планировании направленного синтеза пептидов, обладающих цитопротективным действием.
Основные положения, выносимые на защиту:
- Седатин уменьшает язвенно-эрозивные поражения, индуцированные в желудке нестероидными противовоспалительными препаратами.
- В реализации морфогенетических эффектов седатина важная роль принадлежит его способности ослаблять проявления окислительного стресса.
- Обработка икры осетровых рыб седатином оптимизирует процессы развития молоди.
Публикации:
По материалам диссертации опубликовано 32 научных работ (из них 16 – в изданиях рекомендуемых Высшей Аттестационной Комиссией), 2 патента РФ, 4 статьи в международных журналах; 3 – тезисы докладов на конференциях с международным участием.
Апробация работы:
Основные положения диссертации представлены на 2-ом съезде физиологов Сибири и Дальнего Востока (Новосибирск, 1995); на научно-практической конференции с международным участием «Проблемы фармакологии и фармации на Дальнем Востоке» (Хабаровск, 1997); на научно-практической конференции с международным участием «Фундаментальные и клинические аспекты охраны здоровья детского и взрослого населения Дальневосточного региона» (Хабаровск, 2003); на научно-практической конференции «Актуальные проблемы гастроэнтерологии» (Хабаровск, 2010).
Внедрение результатов:
Полученные данные о характере влияния регуляторных пептидов (синтетических аналогов дерморфина) на состояние тканевого гомеостаза внедрены в курс лекций на кафедре нормальной физиологии ДВГМУ. Использование седатина по запатентованной нами схеме применяется на рыборазводных предприятиях Крайрыбакколхозсоюза, а также на Владимировском, Анюйском и Новоамурском предприятиях.
Объем и структура диссертации:
Диссертация состоит из оглавления, списка сокращений, введения, 6 основных глав, выводов и списка литературы, включающего ссылки на публикации 152 отечественных и 331 иностранных авторов. Объем диссертации составляет 201 страницы машинописного текста и включает 24 таблицы и 27 рисунков.
Содержание работы
Характеристика исследуемых веществ
Изучали влияние дерморфина и его аналогов на морфогенетические процессы у млекопитающих и рыб. Cинтез пептидов осуществлялся в лаборатории химии пептидов (Институт биоорганической химии им. академиков М. М. Шемякина и Ю. А. Овчинникова РАН) профессором, д.м.н. В.И. Дейгиным и к.б.н. Е.П. Яровой. В настоящей работе исследовали дерморфин и пептиды, получившие условные названия в лаборатории и имевшие следующие структурные формулы:
«дерморфин» - Н-Tyr-D-Ala-Phe-Gly-Tyr-Pro-Ser-NH2
«A-10» - H-Tyr-D-Orn-Phe-Gly-OH
«A-43» - H-Arg-Tyr-D-Arg-Phe-D-Ala-NH2
«A-17» - H-Arg-Tyr-D-Lys-Phe-Gly-OH
«седатин» - H-Arg-Tyr-D-Ala-Phe-Gly-OH
«седатин без аргинина» - H-Tyr-D-Ala-Phe-Gly-OH
Пептиды синтезировались с применением классического и твердофазного методов синтеза. Очистка и контроль производилась с помощью ВЭЖХ (высокоэффективной обращеннофазовой жидкостной хроматографии) и тонкослойной хроматографии, в условиях, индивидуально подобранных для каждого аналога. Содержание пептидов в сухом веществе составляло не менее 97,5%. Вещества идентифицированы данными метода 1Н-ЯМР спектроскопии высокого разрешения (500 МГц.). Мы благодарим д.м.н., проф. В.И. Дейгина за предоставленные вещества.
По результатам биологического тестирования А10 и А43 относятся, в основном, к классу μ- агонистов (тест GPI). А17 и седатин проявляют подобные свойства в отношении μ- рецепторов, но, по сравнению с А10 и А43, активно взаимодействуют с δ- рецепторами (тест MVD).
В экспериментах, где применялся ингибиторный анализ, использовались вещества L-NAME и налоксон:
«L-NAME» - метиловый эфир NG-нитро-L-аргинина («ICN Biomedicals Inc.», USA) – неселективный ингибитор cNOS использовался в дозе 9,3х10-5 моль/кг (Boer R. et al., 2000).
«Налоксон» – налоксон-гидрохлорид (“Endo Lab.”, USA) – блокатор опиоидных рецепторов, использовался в дозе 5,5х10-4 моль/кг.
Экспериментальные животные, объекты
и методы исследования
Опыты проводили на белых крысах-самцах массой 160-210 г., и самцах белых мышей массой 25 – 30 г. Содержание животных и проведение экспериментов осуществлялось в соответствии с «Правилами проведения работ с использованием экспериментальных животных», утвержденными Приказом МЗ СССР № 755 от 12.08.77 г. Экспериментальные группы формировали из 8-12 животных, достоверно не различающихся между собой по показателю массы.
Животных содержали при температуре 18-20оС, естественном световом режиме и свободном доступе к воде и пище. Всего в работе использовано 1123 животных. Дерморфин и его аналоги исследовали в дозах 0,1 мкг/кг–1 мг/кг. В основной группе исследований пептид вводился в дозе 10–100 мкг/кг. Вещества вводили внутрибрюшинно с 11 до 12 часов дня. Контролем служили интактные животные, а также животные, подвергнутые инъекции эквиобъемного количества (0,1 мл на 100 г. массы тела) стерильного изотонического раствора хлорида натрия в соответствующем режиме.
Объектом исследования служили эпителиальные ткани лабораторных мышей и крыс. Изучали влияние пептидов на синтез ДНК в эпителии роговицы и слизистой оболочке фундального отдела желудка.
Кроме внутрибрюшинного введения дерморфина и его аналогов лабораторным мышам и крысам, исследовалась аппликация пептидов на роговицу и инкубация культуры фибробластов. В экспериментах с осетровыми породами рыб осуществлялась водная аппликация веществ (Лаптев В.И., 1981). В ряде экспериментов исследовали свойства пептидов в отношении заживления язв ЖКТ. На фоне пятидневного введения пептида в дозе 100 мкг/кг животные через желудочный зонд получали раствор нестероидных противовоспалительных препаратов (индометацина) в дозе 250 мг/кг, что вызывало повреждения СОЖ. Использовались зонды оригинальной конструкции (двух размеров – для мышей и крыс).
Морфометрическую оценку действия пептида осуществляли путем вычисления суммарной площади язв слизистой оболочки желудка. Использовали компьютерную морфометрическую приставку «МЕКОС-Ц»
Эвтаназию осуществляли посредством быстрой декапитации предварительно оглушенных крыс через 4 и 24 часа после заключительной инъекции пептида.
При оценке влияния аналогов дерморфина на развитие осетра амурского Acipenser schrenckii исследования проводили на икре и молоди. Получение половых продуктов и выращивание мальков амурского осетра осуществлялось в производственно-экспериментальных цехах рыболовецких колхозов «Новоамурский», Анюйский РЗ, Владимировский РЗ. Инкубацию осетровых осуществляли в стадии набухания оплодотворенной икры. Контрольные и подопытные образцы икры получены от одной самки для минимизации генетических различий. Каждая экспериментальная и контрольная группы включали около 30000 икринок. После вылупливания предличинок поштучно пересаживали по 2500 особей в бассейны на подращивание. Наблюдение за общим состоянием, поведенческими реакциями, а также анализ соматометрических показателей молоди осетра осуществляли в течение 2 месяцев (60 дней) – с момента выклева до периода помещения особей в естественную среду обитания. Массо-ростовые показатели, индекс упитанности по Фултону определяли на 22, 38, 60 сутки.
Процессы синтеза ДНК оценивали с помощью авторадиографии с 3Н-тимидином. Тимидин вводили в дозе 0,6 мкКu/г массы тела крысам и 1 мкКu/г массы тела мышам. Радиоавтографы изготавливали по принятой в лаборатории методике. Использовали фотоэмульсию двух видов: производства НИИХИМФОТО и KODAK Autoradigraphy Emulsion, (Type NTB, for Light Microscope Autoradiography). Индекс меченых ядер (ИМЯ) определяли на основании просмотра 2,5-3 тысяч клеток и выражали в процентах. Интенсивность метки (ИМ) подсчитывали как среднее количество зерен серебра над 50 мечеными клетками.
Определение морфометрических показателей ядрышек и ядра проводили, основываясь на работах Мамаева Н.Н. и соавт. (1989) и Цыганкова В.И. и соавт. (2004, 2006). Под притертые стекла, покрывающие депарафинированные и гидратированные срезы, вводили гель из смеси 1 части желатины, приготовленной на 1% растворе муравьиной кислоты и 2 частей 50% раствора азотнокислого серебра. Стекла выдерживали в термостате при 37o С 10-15 минут. Морфометрию ядрышек и ядер проводили на анализаторе изображения «МЕКОС–Ц», окуляр 7х, объектив 60х. Для определения содержания общего белка в мышцах рыб в препаратах, окрашенных амидочерным 10В, оценивали оптическую плотность мышечных волокон, служившую показателем концентрации суммарного белка. Измерения не менее 50 мышечных клеток каждой особи проводили на анализаторе изображения «МЕКОС-Ц». Проводили морфометрию средней и интегральной оптической плотности миоцитов, их площади и периметра.
Для интегральной оценки процессов свободнорадикального окисления гомогенатов тканей желудка и сыворотки крови использовали метод хемилюминесценции. Регистрацию ХЛ осуществляли на люминесцентном спектрометре LS 50B «PERKIN ELMER». Спонтанную и индуцированную Fe2+ ХЛ исследовали по методу Владимирова Ю.А. (1991) и Арутюнян А.В. (2000). Определяли: светосумму за 1 мин. спонтанной ХЛ (Sсп.), величина которой коррелирует с интенсивностью генерации свободных радикалов; максимум быстрой вспышки (H1) индуцированной ХЛ, свидетельствующий о содержании гидроперекисей липидов, светосумму (Sинд.1) за 2 мин. после "быстрой" вспышки, отражающую скорость накопления перекисных радикалов липидной природы. Кинетику ХЛ, инициированную H2O2 в присутствии люминола анализировали по двум параметрам (Арутюнян А.В. и соавт., 2000): максимуму свечения (H2), указывающему на потенциальную способность биологического объекта к перекисному окислению, и светосумме за 2 мин. ХМЛ (Sинд.2), величина которой свидетельствует об активности антиоксидантной антирадикальной защиты. Интенсивность ХЛ, измеренную в милливольтах, рассчитывали на 1 г влажной ткани или в 1 мл сыворотки, выражали в относительных единицах.
Определение содержания гистамина в ткани желудка белых мышей проводили флюориметрическим методом (Сидельников Ю.Н., Сиворакша Г.А., 1994).
Исследования процессов пролиферации в культуре дермальных фибробластов белых крыс проводились на первичной культуре по методике, описанной Д.С. Саркисовым и соавт. (1995). Обработка регуляторными пептидами проводилась путем добавления раствора пептида в культуральную среду в концентрации 100 мкг/мл с последующей инкубацией в течение 3 часов. Затем, для приготовления радиоавтографов, клеточные монослои помещали в раствор 3Н-тимидина (1 мкКu/мл) на 1 час. После отмывки монослоев в растворе Хэнкса и фиксации в 96% этаноле производили приготовление радиоавтографов по принятой в лаборатории методике.
Статистическую обработку экспериментальных данных проводили с использованием компьютерной программы «Statistica 5.5». Данные подопытных и контрольных групп подвергали статистической обработке с использованием t-критерия Стьюдента. Различия считали достоверными при р<0,05 (Рокицкий П.Ф., 1961; Сепетлиев Д.А., 1968; Боровиков В.П., 1998).
Результаты исследования и их обсуждение
Собственные исследования подразделяются на три части:
1. Влияние дерморфина и его аналогов на процессы синтеза ДНК в различных клеточных популяциях;
2. Влияние дерморфина и его аналогов на индуцируемое индометацином повреждение слизистой оболочки желудка;
3. Влияние аналогов дерморфина на ранние периоды развития рыб осетровых пород.
Влияние дерморфина и его аналогов на процессы синтеза ДНК
в различных клеточных популяциях
При однократом введении селективных мю-агонистов – дерморфина, А10 и А43 в дозе 10 мкг/кг имело место достоверное уменьшение ИМЯ в роговице через 4 и 24 часа после инъекции в 1,8 – 2,0 раза. Мю-дельта- агонисты седатин и А17 в этой дозировке не оказывали влияния на синтез ДНК в эпителии роговицы. Введение А10, А43, седатина и А17 привело к достоверному увеличению ИМЯ в эпителии фундального отдела желудка через 24 часа после введения пептидов. Аналогичная картина имела место при пятикратном введении пептидов в дозе 100 мкг/кг; при этом, мю-дельта-агонист седатин вызывал почти двукратное увеличение ИМЯ в эпителии роговицы. В эпителии желудка введение всех трех мю-агонистов (дерморфина, А10, А43) и введение мю-дельта-агонистов (седатина и А17) активировало синтез ДНК ( ИМЯ увеличивался в 1,4 – 1,5 раза). Это совпадает с данными литературы о том, что в тканях, где широко представлены мю-рецепторы, опосредующие аналгетический эффект, при введении лигандов этих рецепторов имеет место торможение процессов пролиферации (Радивоз М.И. и соавт., 1991; Тимошин С.С. и соавт., 1993). В энтодермальном эпителии желудка, где главным образом представлены дельта-рецепторы, мю-агонисты, взаимодействуя с ними, стимулируют пролиферативные процессы (Тимошин С.С. и соавт., 1993).
Другим существенным положением, основанным на данных этой группы экспериментов, было свойство остатка молекулы аргинина модифицировать способность опиатных пептидов оказывать влияние на пролиферативные процессы (рис. 1).
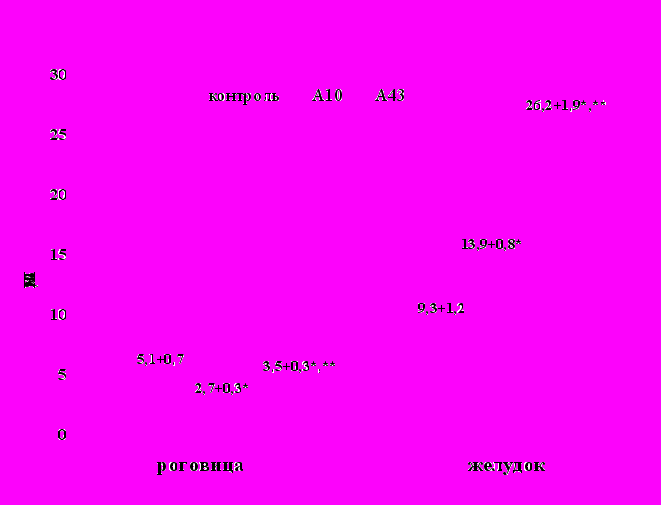
Рисунок 1. Влияние мю-агонистов опиатных рецепторов на
Рис. 1. Процессы синтеза ДНК в эпителии роговицы через 4 часа после введения пептидов и желудка – через 24 часа после введения пептидов.
Примечание: * р<0,05 по отношению к контролю.
* * р<0,05 различия достоверны между подопытными группами.
Синтетические аналоги дерморфина А10 и А43 являются селективными мю-агонистами (Ярова Е.П., 1987), при этом в структуре А43 аргинин присутствует в С-концевом положении. Присутствие аргинина в молекуле аналога дерморфина привело к достоверно меньшей депрессии ИМЯ в эпителии роговицы и к более выраженной стимуляции в эпителии желудка по сравнению с «безаргининовым» А10.
Доказательством зависимости митогенного эффекта аналогов дерморфина от присутствия в структуре пептида остатка аргинина послужили результаты опытов по оценке влияния на пролиферацию седатина (H-Arg-Tyr-D-Ala-Phe-Gly-OH) и его безаргининового аналога (H-Tyr-D-Ala-Phe-Gly-OH).
Пятикратное введение седатина в дозе 100 мкг/кг индуцировало выраженную стимуляцию процессов синтеза ДНК в эпителии СОЖ – ИМЯ увеличился в 1,6 раза, ИМ при этом не изменялась (табл. 1).
Таблица 1
Влияние пятикратного введения аналогов дерморфина на процессы синтеза ДНК в эпителии желудка белых крыс (M ± m)
| контроль | седатин | седатин без аргинина | |||
| ИМЯ% | ИМ | ИМЯ% | ИМ | ИМЯ% | ИМ |
| 10,19±0,62 | 7,59±0,87 | 16,32±0,99* | 9,41±1,56 | 10,35±0,93 | 6,98±0,72 |
Примечание: * p<0,05
Безаргининовый аналог не оказал влияния на процессы синтеза ДНК. Аналогичная картина имела место в опытах с другим аргининсодержащим опиатным пептидом даларгином. В то время, как даларгин (Tyr-DAla-Gly-Phe-Leu-Arg), стимулировал синтез ДНК в эпителии фундального отдела желудка, его безаргининовый аналог утрачивал эту способность (Животова Е.Ю и соавт., 2007). На примере даларгина было показано, что в начальный период метаболизма in vivo происходит отщепление остатка аргинина от молекулы пептида. Aргинин является важным фактором фунционирования системы NOS-NO, которая, в свою очередь, является ключевым фактором поддержания кровотока в желудке, обеспечивающего поддержание целостности СОЖ. Для оценки роли этого механизма в реализации митогенного действия седатина были проведены эксперименты с блокадой NOS с помощью L-NAME. Результаты представлены в таблице 2.
Таблица 2
Влияние пятикратного введения седатина и L-NAME на процессы синтеза ДНК в эпителии желудка белых крыс (M ± m)
| контроль | L-NAME | L-NAME+седатин | |||
| ИМЯ% | ИМ | ИМЯ% | ИМ | ИМЯ% | ИМ |
| 12,49±1,15 | 19,1±1,55 | 7,67±0,84* | 13,5±1,0* | 6,52±0,53* | 14,7±1,65* |
Примечание: * p<0,05
Наши данные совпадают с результатами исследований, в которых введение L-NAME приводило к угнетению синтеза ДНК в миокарде новорожденных крыс. При этом, в эпителии кожи и в мышечной оболочке кишечника синтез ДНК не изменялся (Сазонова Е.Н., Пикалова В.М., Тимошин С.С., 2002). Введение седатина на фоне L-NAME не оказало влияния на процессы пролиферации по сравнению с группой животных, получавших только L-NAME. Эти эксперименты подтвердили важную роль тонического влияния NO-NOS на поддержание тканевого гомеостаза в СОЖ. Блокада NOS привела к выраженному угнетению синтеза ДНК в СОЖ. ИМЯ уменьшился в 1,6 раза. Уменьшение числа ДНК-синтезирующих ядер сопровождалось уменьшением ИМ, свидетельствующим о замедлении скорости синтеза ДНК. Такая же закономерность имела место в эксперименте с даларгином. Введение его на фоне L-NAME отменяло способность стимулировать синтез ДНК в СОЖ (Животова Е.Ю и соавт., 2007).
Результаты этих исследований, в определенной степени, объясняют механизмы, через которые аргининсодержащие опиоидные пептиды реализуют свое воздействие на тканевой гомеостаз. Несмотря на наличие общих свойств у даларгина и седатина, некоторые физиологические и цитофизиологицеские эффекты различны. Оба пептида обладают антистрессорной активностью, при этом даларгин оказывает гипотензивное и релаксирующее влияние, а седатин повышает концентрацию внимания. В наших экспериментах седатин и его безаргининовый аналог не оказывали влияния на процессы синтеза ДНК в дермальных фибробластах in vitro. В опытах Е.Ю. Животовой (2010) даларгин стимулировал синтез ДНК в фибробластах. Аппликация седатина на роговицу не оказывала влияния на синтез ДНК, в то время, как даларгин в этих условиях оказывал стимулирующее влияние.
Особо следует подчеркнуть способность седатина стимулировать синтез ДНК в эпителии желудка в широком диапазоне доз от 0,1 мкг/кг до 1 мг/кг (табл. 3).
Таблица 3
Влияние пятикратного введения различных доз седатина
на процессы синтеза ДНК в эпителии желудка белых крыс (M ± m)
| Группа животных | Дозы пептида | ||||
| 0,1 мкг/кг | 1 мкг/кг | 10 мкг/кг | 100 мкг/кг | 1 мг/кг | |
| ИМЯ % через 24 часа после инъекции | |||||
| контрольная | 6,44±0,64 | 6,44±0,64 | 7,31±0,42 | 7,54±0,53 | 6,44±0,64 |
| подопытная | 10,73±1,13* | 9,13±0,31* | 11,10±0,51* | 11,61±1,11* | 13,02±1,57* |
Примечание: * р< 0,05
Индекс меченых ядер увеличивался в 1,42 - 2,02 раза. Дозы 0,1 мкг/кг и 1 мкг/кг приблизительно соответствуют 1,3×10-10 М/кг и 1,3×10-9 М/кг, что вполне сопоставимо со сверхнизкими дозами иммуноактивных пептидов, стимулировавших пролиферативные процессы в исследованиях Григорьева Е.И. и соавт. (2003).
Определенный вклад в стимуляцию пролиферативных процессов в СОЖ под влиянием седатина осуществляется за счет способности пептида оптимизировать процессы СРО в тканях желудка (табл. 4).
Таблица 4
Влияние введения седатина и безаргининового аналога седатина на показатели хемилюминесценции (в отн. ед.) гомогенатов желудка самцов белых крыс (M±m)
| | Sсп. | Инд. ХМЛ (Fe2+) | Инд. ХМЛ (люминол-Н2О2) | ||
| Н1 | S1инд. | H2 | S2инд. | ||
| Контроль Седатин Безарг. аналог седатина | 1,330±0,093 0,739±0,057* 1,450±0,081 | 2,280±0,077 1,500±0,093* 2,180±0,092 | 2,882±0,141 1,896±0,128* 2,209±0,121* | 2,150±0,106 1,77±0,09* 2,020±0,143 | 1,090±0.099 0,660±0,053* 1,060±0,094 |
Примечание: * p<0,05
Седатин проявил выраженные антиоксидантные антирадикальные свойства, о чем свидетельствует уменьшение значений S2инд , Н2 в 1,7 и 1,2 раза, соответственно. Это способствовало угнетению продукции свободных радикалов в целом (Sсп сократилась в 1,8 раза). Кроме того, наблюдалось снижение уровня гидроперикисей липидов (Н1) в 1,5 раза и торможение процессов образования и накопления перекисных радикалов (S1инд) в 1,5 раза. Введение безаргининового аналога седатина сопровождалось лишь снижением скорости образования свободных радикалов (S1инд снизилась в 1,3 раза).
Мы считаем, что наличие аргинина в синтетических аналогах опиоидных пептидов не определяет многообразия их биологических эффектов. Однако присоединение аргинина к лиганду опиоидных рецепторов приводит к модификации их морфогенетической активности.
Не универсальный митогенный эффект седатина в различных клеточных популяциях, сочетающийся с его способностью стимулировать синтез ДНК в эпителии СОЖ в широком диапазоне доз, опосредованность этого эффекта через активацию синтеза NO и ослабление проявления оксидативного стресса послужили предпосылками для применения пептида в целях профилактики НПВП-гастропатий.
Влияние дерморфина и его аналогов на индуцируемое индометацином повреждение слизистой оболочки желудка
НПВП-гастропатии у мышей моделировали посредством внутрижелудочного введения индометацина по описанной ранее методике. Средняя площадь язвенно-эрозивного поражения у животных, получавших индометацин без предварительного воздействия пептидов, составила 8,12±0,91 мм2. Введение дерморфина недостоверно снизило площадь повреждения СОЖ (7,10±1,10 мм2); пептид А10 утяжелил картину поражения слизистой (9,21±1,24 мм2), но различия также носили недостоверный характер. Результаты исследования состояния СОЖ у животных, получавших индометацин на фоне пятикратного введения седатина, свидетельствуют о протективном действии препарата в этих условиях (рис. 2). Об этом можно судить по уменьшению площади язвенно-эрозивных дефектов: в то время, как у животных, получавших индометацин, средняя площадь повреждения СОЖ составила 7,43±1,0 мм2, площадь язвенно-эрозивных дефектов СОЖ у мышей, получавших индометацин на фоне пятикратного введения седатина, уменьшилась до 4,24±1,12 мм2 , то есть, поражение СОЖ уменьшилось в 1,75 раз.
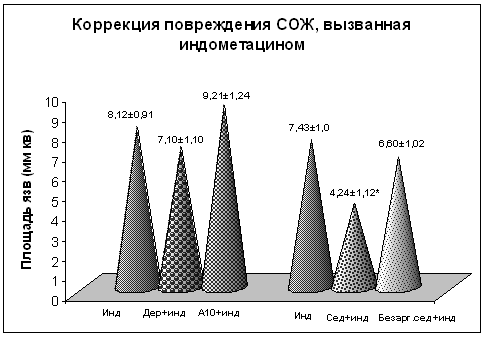
Рис. 2: Влияние дерморфина и его аналогов на площади эрозивно-язвенного повреждения слизистой оболочки желудка белых мышей,
индуцируемые индометацином.
Примечание: * достоверное отличие от группы «индометацин» (р<0,05)
Одной из причин изъязвления СОЖ при воздействии НПВП считается угнетение процессов синтеза ДНК. В наших исследованиях наблюдалось достоверное уменьшение ИМЯ. В то время как показатель ИМЯ в контрольной группе составил 9,60 ± 0,34; у животных, получавших индометацин, ИМЯ уменьшился до 5,28 ± 0,20, то есть, в 1,8 раз (табл. 5). Другим важным показателем нарушения процессов пролиферации под воздействием индометацина является уменьшение ИМ, косвенно свидетельствующее об уменьшении скорости синтеза ДНК: в контроле ИМ составила 19,16 ± 0,70; под воздействием индометацина ИМ уменьшилась в 1,7 раз и составила 11,16 ± 0,90. Сочетание уменьшения количества ДНК синтезирующих клеток с уменьшением скорости прохождения клетками S-периода свидетельствует о выраженном нарушении процессов пролиферации.
Таблица 5
Влияние седатина и его безаргининового аналога на процессы синтеза ДНК в слизистой оболочке желудка белых мышей, получавших индометацин (M±m).
| | ИМЯ, % | ИМ |
| контроль | 9,60 ± 0,34 | 19,16 ± 0,70 |
| индометацин | 5,28 ± 0,20* | 11,16 ± 0,90* |
| седатин пятикратно + индометацин | 7,92 ± 0,44 | 19,20 ± 1,17 |
| безаргининовый седатин пятикратно + индометацин | 5,38 ± 0,51* | 14,95 ± 1,69* |
Примечание: * р<0,05
Одним из механизмов протективного действия седатина при НПВП-гастропатиях, на наш взгляд, является его способность стимулировать пролиферативные процессы. Хотя ИМЯ в группе животных, получавших индометацин на фоне пятикратного введения седатина, оставался на уровне 7,92+0,44 (достоверно ниже показателя ИМЯ в группе интактного контроля), он достоверно – в 1,5 раза (р<0,05), превышал значение ИМЯ у животных из группы, получавшей только индометацин. Безаргининовый аналог седатина не оказал достоверного цитопротективного эффекта. Об этом свидетельствует отсутствие различий в величинах ИМЯ в СОЖ у животных в группах «индометацин» и «безаргининовый аналог седатина + индометацин».
Результаты ХМЛ анализа гомогенатов желудка животных, получавших НПВП, свидетельствуют о формировании выраженного оксидативного стресса. Все исследуемые показатели, характеризующие СРО, увеличивались, по сравнению с интактным контролем, в 2,7 – 4,8 раза (табл. 6).
Таблица 6
Влияние седатина и его безаргининового аналога на показатели
хемилюминесценции (в отн. ед.) гомогенатов желудка белых мышей,
получавших индометацин (M±m)
| | Sсп. | Инд. ХМЛ (Fe2+) | Инд. ХМЛ (люминол-Н2О2) | ||
| Н1 | S1инд. | H2 | S2инд. | ||
| контроль | 1,04±0,06 | 1,52±0,08 | 2,43±0,09 | 1,58±0,07 | 0,86±0,05 |
| индометацин | 3,26±0,24* | 4,17±0,22* | 9,32±0,60* | 5,94±0,37* | 4,12±0,20* |
| седатин + индометацин | 2,17±0,11* | 3,10±0,19* | 4,87±0,25* | 2,95±0,19* | 1,89±0,14* |
| седатин без аргинина + индометацин | 3,12±0,21* | 4,05±0,26* | 8,85±0,57* | 6,15±0,30* | 4,61±0,25* |
Примечание: * p<0,05
Полученные нами результаты соответствуют литературным данным о свободнорадикальных механизмах гастротоксичности нестероидных противовоспалительных препаратов (Евсеев М. А., 2007). Предварительное воздействие седатина вызывает коррекцию прооксидантно-антиоксидантного статуса тканей желудка у животных, получавших индометацин (табл. 6). Хотя ни один из исследуемых ХМЛ-показателей не достиг контрольного уровня, все они значительно приблизились к нему, достоверно изменившись в сравнении с показателями группы животных, получавших индометацин без коррекции – пятикратного введения седатина. Интенсивность СРО снижалась и за счет угнетения первичного этапа пероксидации липидов и замедления образования перекисных радикалов. Об этом свидетельствует уменьшение амплитуды Н1 – в 1,3 раза и величины S1 инд.. – в 1,9 раза, при сравнении показателей групп «индометацин» и «седатин + индометацин» (табл. 6). Подтверждением роли фланкирующего аргинина в реализации биологических эффектов седатина были результаты ХМЛ анализа (оценка действия седатина и безаргининового аналога седатина). Отсутствие в пептиде молекулы аргинина привело к потере антирадикальных свойств. Защитный эффект седатина при индометациновом повреждении СОЖ мог быть обусловлен селективной коррекцией нарушений в системе L-arginine-NOS-NO, играющей важную роль в формировании прооксидантно-антиоксидантного равновесия (Jones D.P., 2008).
Важным свойством седатина в реализации протективного действия по отношению к СОЖ, является сочетание в нем способности ослаблять выраженность оксидативного стресса и индуцировать образование NO. При оксидативном стрессе из NO образуется токсичный пероксинитрит (ONOO-), который, индуцирует процессы апоптоза и некроза. При нормализации прооксидантно-антиоксидантного равновесия NO осуществляет свои цитофизиологические эффекты, в частности, нормализует микроциркуляцию и стимулирует пролиферативные процессы в СОЖ (Ahmad R. et al., 2009).
Доказательством участия системы L-аrginine-NOS-NO в адаптации СОЖ являются результаты опытов с введением ингибитора NOS L-NAME. В то время, как у интактных животных ИМЯ в эпителии СОЖ составил 4,10±0,83, у животных, получавших L-NAME+ индометацин, он составил 2,33±1,60. Введение L-NAME животным, получавшим, наряду с индометацином, седатин, нивелировало цитопротективный эффект седатина. ИМЯ в СОЖ у животных, получавших «L-NAME+седатин+индометацин», был 2,92±0,61, достоверно не отличался от соответствующего показателя группы «L-NAME+ индометацин», и в обоих случаях величина ИМЯ была достоверно ниже величины ИМЯ интактного контроля. Полученные нами результаты, в определенной степени, подтверждают выводы наших предыдущих исследований о важной роли молекулы аргинина в реализации морфогенетических и антиоксидантных свойств седатина (Флейшман М.Ю. и соавт., 2007). Одним из возможных механизмов, через которые седатин опосредует свои защитные эффекты, является изменение концентрации гистамина в СОЖ (табл. 7).
В наших опытах, на фоне индуцируемых НПВП язв и эрозий, имело место более чем двукратное падение концентрации гистамина в тканях желудка. Это свидетельствует в пользу гипотезы о том, что дефицит гистамина является одним из факторов нарушения целостности СОЖ. Способность седатина нормализовать содержание гистамина помогает выявить еще один механизм его цитопротективного действия. Тот факт, что способностью нормализовать концентрацию гистамина, наряду с седатином, обладал его безаргининовый аналог, выводит полученные результаты из общей закономерности, согласно которой cедатин проявляет цитопротективные свойства только при наличии в структуре аргинина.
Таблица 7
Влияние пятикратного введения аналогов дерморфина в дозе 100 мкг/кг
на концентрацию гистамина в ткани желудка белых мышей (M ± m)
| группа животных | концентрация гистамина (мкг/г ткани) |
| контроль | 4,21±0,81 |
| изотон. р-р NaCl пятикратно + индометацин | 2,07±0,38 * |
| седатин | 5,91±0,88 * |
| седатин + индометацин | 3,37±0,44 * |
| седатин без аргинина | 4,24±0,58 * |
| седатин без аргинина + индометацин | 3,51±0,31 * |
