Звіт про науково-дослідницьку роботу морфофункціональні особливості перебудови скелета та внутрішніх органів в умовах порушеного гомеостаза
| Вид материала | Документы |
- Реферат звіт про науково-дослідницьку роботу:, 74.48kb.
- Реферат звіт про науково-дослідну роботу, 23.08kb.
- Реферат звіт про науково-дослідну роботу, 29.85kb.
- Реферат звіт про науково-дослідну роботу, 18.54kb.
- Реферат звіт про науково-дослідну роботу заключний, 39.02kb.
- З в І т Миргородського міського голови про роботу міської ради та її виконавчих органів, 765.99kb.
- Ся з метою інтеграції наукової та навчальної діяльності в системі вищої освіти,, 67.58kb.
- На науково-дослідницьку роботу Чупілки, 213.36kb.
- Розділ особливості діяльності органів внутрішніх справ, пов’язані з проблемою незаконного, 866.96kb.
- Міністерство освіти І науки України Кременчуцький державний політехнічний університет, 663.7kb.
УДК 611/71:612/1/2-2008
КП
№ держрегістрації 0107U001287
Інв. №
Міністерство освіти і науки України
Сумський державний університет
(СумДУ)
40007, м. Суми, вул. Римського-Корсакова, 2,
тел/факс (0542) 33-41-08
ЗАТВЕРДЖУЮ
Проректор з наукової роботи
д-р фіз.-мат. наук, професор
А.М. Чорноус
ЗВІТ
ПРО НАУКОВО-ДОСЛІДНИЦЬКУ РОБОТУ
МОРФОФУНКЦІОНАЛЬНІ ОСОБЛИВОСТІ ПЕРЕБУДОВИ СКЕЛЕТА ТА ВНУТРІШНІХ ОРГАНІВ В УМОВАХ ПОРУШЕНОГО ГОМЕОСТАЗА
(заключний)
Начальник науково-дослідницької частини
канд. техн. наук, доцент В.А. Осіпов
Керівник НДР
зав. кафедрою анатомії людини
д-р мед. наук, професор В.З. Сікора
2008
Рукопис закінчений 1 грудня 2008 р.
Результати роботи розглянуті науковою радою університету,
Протокол від 28.01.09 №
СПИСОК АВТОРІВ
Керівник НДР
зав. кафедрою анатомії людини В.З. Сікора
д-р мед. наук, професор (розд. 1, 2 ,3, 4 висновки)
Доцент кафедри анатомії людини О.О. Устянський
канд. мед. наук, доцент (розд. 1, 2 ,3, 4 висновки)
Доцент кафедри анатомії людини В.І. Бумейстер
канд. б. наук, доцент (розд. 1, 2 ,3, 4 висновки)
Доцент кафедри анатомії людини В.Ю. Ільїн
канд. мед. наук, доцент (розд. 1, 2 ,3, 4)
Доцент кафедри анатомії людини Г.Ф. Ткач
канд. мед. наук, доцент (розд. 3, 4)
Асистент кафедри анатомії людини М.В. Погорєлов
канд. мед. наук (розд. 3, 4)
Асистент кафедри анатомії людини О.С. Погорєлова
канд. мед. наук (розд. 1, 4)
Ст. викладач кафедри анатомії людини Л.Г. Сулім
(розд. 1, 2 ,3, 4)
Ст. викладач кафедри анатомії людини І.В. Болотна
(розд. 1, 4)
Асистент кафедри інфекційних хвороб В.В. Захлєбаєва
канд. мед. наук (розд. 3, 4)
Асистент кафедри травматології В.В. Сікора
канд. мед. наук (розд. 2 ,3)
Провідний фахівець лабораторії О.В. Гордієнко
Електронної мікроскопії (розд. 2 ,3)
Студент п'ятого курсу С.Д. Бончев
(розд. 1, 2 )
РЕФЕРАТ
Звіт викладений на 62 сторінках друкованого тексту і складається зі вступу, суті звіту, висновків, практичних рекомендації, списку літератури, який містить 58 джерел, 1 таблиці і 3 малюнків.
Робота виконана на 380 лабораторних білих щурах-самцях молодого, зрілого і старечого віку.
Мета – визначення на макро- і мікро структурному рівнях закономірностей перебудови міокарда, нирки, печінки і довгих кісток скелета, а також зміни їх хімічного складу за умов дії солей важких металів і малих доз іонізуючого опромінення в експерименті у тварин.
Використовувалися органометричні, гістологічні, морфометричні, ультрамікроскопічні, хіміко аналітичні і математичні методи дослідження.
Вперше на експериментальному матеріалі проведене комплексне вивчення особливостей структурних перетворень під впливом техногенних мікроелементозів і опромінення малими дозами, що полягають в деструктивних змінах паренхіми печінки і нирок, міокарда шлуночків серця, затримці росту формоутворення довгих кісток скелета та порушенні їх мінеральної насиченості. Виявлена залежність морфологічних змін від дози радіації, виду солей важких металів і терміну їх споживання, що має лінійний характер. Вивчені негативні порушення у щурів молодого, зрілого і старечого віку в умовах дії екологічних чинників Сумщини.
Результати роботи впроваджені в наукові розробки і на навчальний процес 12 морфологічних кафедр медичних ВНЗ України.
Робота закінчується 19 висновками і 4 практичними рекомендаціями.
МІКРОЕЛЕМЕНТОЗИ, СОЛІ ВАЖКИХ МЕТАЛІВ, ПЕЧІНКА, НИРКА, МІОКАРД, ДОВГІ КІСТКИ, МОРФОЛОГІЧНІ ЗМІНИ, ХІМІЧНИЙ СКЛАД
ЗМІСТ
Вступ 5
Суть звіту 8
1 Матеріали та методи дослідження 8
2 Результати дослідження та їх обговорення 14
2.1 Дослідження серця в умовах надмірного
споживання солей важких металів 14
2.2 Дослідження нирок в умовах дії
малих доз радіації та солей важких металів 23
2.3 Дослідження печінки в умовах дії
малих доз радіації та солей важких металів 33
2.4 Дослідження довгих кісток в умовах дії
малих доз радіації та солей важких металів 38
Висновки 52
Практичні рекомендації 56
Список використаних джерел 57
ВСТУП
Урбанізація суспільства, ріст хімічної та електроенергетичної галузей виробництва, використання мінеральних добрив, металомістких пестицидів, викиди у навколишньє середовище відходів виробництва та вихлопів автомобільного транспорту, аварії на промислових підприємствах, підвищенний радіаційний фон за останні десятиріччя здійснюють постійний вплив на живі істоти [1, 2, 3, 4]. Причому в деяких регіонах виникають асоціації елементів, що не є природними, а характерні для техногенних аномалій [5]. Пристосовуючись до нових умов існування, в організмі вмикаються захисні механізми, які протягом певного терміну здатні нівелювати ушкоджуючий вплив небезпечних чинників [6]. Але в подальшому, по мірі виснаження резервів, відбувається зрив адаптації, і пристосувальні механізми перетворюються на патологічні, які виявляються спочатку на клітинному та біохімічному рівнях, а з часом, призводять до морфологічних змін на органному рівні [7].
Одним з найрозповсюджених забруднювачів навколишнього середовища є важкі метали, концентрація яких перевищує допустимі норми в багатьох регіонах України та світу [8, 9, 10, 11]. У Північних регіонах Сумської області в ґрунті та водоймах спостерігається збільшення вмісту іонів міді, цинку, заліза, марганцю, хрому та свинцю, концентрація яких перевищує ГДК у 10-100 разів [12, 13, 14]. До цього слід додати наслідки аварії на ЧАЕС. Вивченню дії важких металів та радіації на організм людини та експериментальних тварин присвячено достатньо робіт, більшість з яких вказують на негативний вплив металів і випромінення на органи та системи [15, 16, 17, 18]. До основних механізмів токсичної дії цих компонентів слід віднести їх безпосередній вплив на тканини та опосередкований, що здійснюється за рахунок блокування ферментних систем і пошкодження генетичного апарату клітини [19].
Дані літератури стосовно впливу несприятливих чинників саме на функціонування міокарда поодинокі та часом недостатньо інформативні (не розкривають зміни на всіх рівнях будови). На теперішній час залишається нез`ясованим питання перебудови міокарда, хімічного складу і мікроструктури кардіоміоцитів за умов дії різних солей важких металів. Не визначені також особливості дії солей важких металів на міокард тварин різного віку.
Враховуючи те, що за останні роки спостерігається ріст патології серцево-судинної системи в усіх вікових групах [20, 21, 22, 23, 24], особливу занепокоєність викликає збільшення захворюваності у дітей та осіб працездатного віку. Серед основних захворювань можна виділити кардіоміопатії та метаболічні порушення у міокарді, причини розвитку яких залишаються до кінця не з’ясованими [25, 26, 27]. Тому розуміння механізмів порушення функціонування міокарда дозволить розробити оптимальні заходи щодо їх профілактики і лікування.
Більшість ксенобіотиків мають системну дію на організм, але нирка, як екскреторний орган є найбільш уразливою, особливо в умовах підвищенного радіаційного фону [28]. Високий рівень кровопостачання і велика довжина тубулярного апарату обумовлюють тривалість контакту екзотоксикантів і їхніх метаболітів з ендотеліальними і епітеліальними клітинами. Позитивний гідростатичний тиск, необхідний для здійснення ультрафільтрації, і оптимальні механізми екскреції спрямовані на збереження есенціальних метаболітів і елімінацію токсинів з мінімальною втратою рідини за допомогою медулярної протиточно-множинної системи, призводять до реабсорбції і рециркуляції в організмі низькомолекулярних метаболітів ксенобіотиків.
Найбільшої агресії з боку екологічних чинників зазнає печінка. Це пов'язано з її детоксикуючими властивостями, тому що цей орган виконує загальну антитоксичну функцію в організмі. Багато промислових відходів, у тому числі і солі важких металів, мають гепатотропну дію [29, 30]. Деякі токсичні речовини (ртуть, свинець, марганець) депонуються в печінці, ушкоджуючи гепатоцити і порушуючи їх функцію, і спричиняють розвиток токсичного ураження печінки [31, 32, 33].
Кісткова система являє собою складну морфофункціональну одиницю організму, що не тільки реагує на зміни нервової та гуморальної систем, а й здатна впливати на організм зміною мінерального складу, в першу чергу вивільненням та депонуванням кальцію, що є одним з механізмів підтримки гомеостазу. [34, 35, 36, 37] В кістковому матриксі депонуються основні макро- та мікроелементи, здатні до звільнення при потребі в них організму. Кістковий мозок, що вміщується в довгих кістках скелету, є регулятором клітинного складу крові і реагує на зміни функціонування кісток. Пошкодження скелету викликає низку локальних та загальних реакцій, які мають суттєві наслідки для всього організму.
Мета роботи. Визначення на макро- та мікроструктурному рівнях закогномірностей перебудови міокарда, нирки, печінки і довгих кісток скелета, а також зміни їх хімічного складу за умов дії солей важких металів і малих доз радіації в експерименті у тварин.
СУТЬ ЗВІТУ
1. Матеріали і методи дослідження.
З метою вивчення впливу комбінації солей важких металів і випромінення проведений експеримент на 370 безпородних щурах-самцях трьох вікових груп: молодих, зрілих та старечого віку, що утримувались у віварії Медичного інститута СумДУ. Вибір щурів як біологічної моделі обумовлений рядом спільних особливостей будови та функції різних органів і систем тварин і людини.
Перед початком експерименту тварин оглядали, враховуючи їх локомоторну активність та стан шкірного покриву. Після вибракування щурів з аномаліями поведінки, тварин вводили в експеримент. Утримання тварин та експерименти проводилися відповідно до положень «Європейської конвенції про захист хребетних тварин, які використовуються для експериментів та інших наукових цілей» (Страсбург, 1985), «Загальних етичних принципів експериментів на тваринах», ухвалених Першим національним конгресом з біоетики (Київ, 2001), Хельсинської декларації Генеральної асамблеї Всесвітньої медичної асоціації (2000). Комісією з питань біоетики Медичного інститута Сумського державного університету (протокол № 1 від 10 березня 2008 р.) порушень морально-етичних норм при проведенні науково-дослідницької роботи не виявлено.
Залежно від віку та впливу комбінацій важких металів усі тварини були поділені на 5 серій.
I серія – яким моделювали екологічну ситуацію Ямпільського району Сумської області, для якої притаманне збільшення вмісту міді, цинку та заліза у водоймах та грунтах, а саме: солей цинку (ZnSO4) – 50 мг/л, міді (CuSО4) – 20,0 мг/л та заліза (FeSO4) – 20 мг/л. Для вивчення вікових особливостей дії мікроелементозів на організм тварин експеримент проводився в межах 3 вікових груп (по 18 особин в кожній): молоді тварини (4-6 місяців), зрілого віку (7-9 місяців) та щурі старечого віку (20-22 місяця). Кожна група тварин отримувала солі важких металів протягом 1, 2 та 3 місяців, що дозволило простежити підгостру дію екзотоксикантів, а також опромінювалися в дозі 0,1, 0,2 і 0,3 Гр.
II серія – тварини трьох вікових груп, яким моделювались екологічні умови Шосткинського району, – протягом 1, 2 та 3 місяців з питною водою додавали солі цинку (ZnSO4) – 50 мг/л, хрому (K2Cr2O7) – 10,0 мг/л і свинцю (Pb(NO3)2) – 3 мг/л і опромінюнення в дозі 0,1, 0,2 і 0,3 Гр.
III серія – тварини трьох вікових груп, яким моделювались екологічні умови Середино-Будського району, – протягом 1, 2 та 3 місяців з питною водою додавали солі марганцю (MnSO4 x 5H2O) - 5,0 мг/л, свинцю (Pb(NO3)2) - 3 мг/л та міді (CuSO4 )– 20,0 мг/л і опромінюнення в дозі 0,1, 0,2 і 0,3 Гр.
ІV серія - контрольна, до якої увійшли інтактні щурі всіх вікових груп, що дозволило провести коректний порівняльний аналіз з експериментальними серіями тварин.
Група експериментальних та контрольних тварин забивалася під ефірним наркозом шляхом декапітації на наступний день після закінчення експерименту. На дослідження забиралися серця щурів.
Для дослідження серця використовувалися такі методики:
1. Морфометричні виміри відділів і камер серця. Серце розтинали за методикою Г.Г. Автанділова (1990), розділяючи його на 4 частини: лівий та правий шлуночки, міжшлуночкову перегородку та передсердя. Окремо зважували частини серця за W. Muller з урахуванням модифікації R.M. Fulton et al., Г.І. Ільїна (38), використовували непряму планіметрію ендокардіальних поверхонь шлуночків серця.
2. Гістологічне дослідження міокарда шлуночків. Вирізалися шматочки міокарда з передніх і бічних стінок лівого та правого шлуночків, міжшлуночкової перегородки. Препарати фіксували в 10 % розчині нейтрального формаліну, після відповідної проводки заливали в парафін. Готували гістологічні зрізи товщиною 10 -15 мкм та забарвлювали їх гематоксилін-еозином, за ван-Гізон та залізним гематоксиліном Гейденгайна.
3. Морфометрія гістологічних препаратів. За допомогою гістоморфометрії визначали діаметр кардіоміоцитів шлуночків (ДКМЛШ і ДКМПШ ), діаметр ядер кардіоміоцитів лівого та правого шлуночків (ДЯКМЛШ і ДЯКМПШ), відносний об'єм кардіоміоцитів лівого та правого шлуночків (ВОКМЛШ і ВОКМПШ), відносний об'єм судин у шлуночках (ВОСЛШ і ВОСПШ), відносний об'єм сполучної тканини в лівому та правому шлуночках (ВОСТЛШ і ВОСТПШ), стромально-кардіоміоцитарне відношення в шлуночках (СТКМВЛШ, СТКМВПШ). Відносні об’єми кардіоміоцитів, судин, сполучної тканини визначалися методом «точкового» підрахунку (Г.Г. Автандилов, 1990; В.Д. Мішалов, 1994), СТКМВ вираховувалося за формулою (ВОСТ+ВОС)/ВОКМ, інші показники – за допомогою комп’ютерної програми «Видео Размер 5,0».
4. Вивчення хімічного складу серця. На атомному абсорбційному спектрофотометрі С-115М1 за загальноприйнятою методикою визначали кількість цинку (довжина хвилі - 213,9 нм), міді (довжина хвилі - 324,7 нм), свинцю (довжина хвилі - 283,3 нм), марганцю (довжина хвилі - 279,5 нм), хрому (довжина хвилі - 357,9 нм), заліза (довжина хвилі - 248,3 нм), кальцію (довжина хвилі - 271,5 нм), магнію (довжина хвилі - 328,4 нм). Концентрацію натрію та калію визначали методом емісії.
Для гістологічних досліджень нирки одразу після її видалення і зважування вирізали шматочки товщиною 5 мм. Матеріал фіксували протягом 2-3 тижнів в 10% розчині нейтрального формаліну з трьохразовою зміною фіксатора, потім зневоднювали в спиртах зростаючої концентрації, після чого заливали у парафінові блоки. Зрізи, товщиною 5-6 мкм, забарвлені гематоксилин-еозином, досліджували у світлооптичному мікроскопі “Olimpus” і документували за допомогою цифрової мікровідеокамери.
Для електронномікроскопічного дослідження з середньої частини кіркової речовини нирки вирізали маленькі шматочки тканини. Матеріал фіксували у 2,5 % розчині глютаральдегіду з активною реакцією середовища Ph 7,3-7,4 приготовленому на фосфатному буфері Міллоніга. Фіксований матеріал через 50-60 хвилин переносили у буферний розчин і промивали протягом 20-30 хвилин. Постфіксацію матеріалу здійснювали 1% розчином чотириокису осмію на буфері Міллоніга протягом 60 хвилин, після чого проводили його дегідратацію в спиртах і ацетоні та заливали в суміш епоксидних смол. Ультратонкі зрізи, виготовлені на ультрамікротомі, забарвлювали 1% розчином уранілацетату, контрастували згідно методу Рейнольдса та вивчали в електронному мікроскопі ПЭМ – 100К.
Для дослідження печінки використовувалися наступні методики:
1. Визначення відносної маси печінки за формулою:
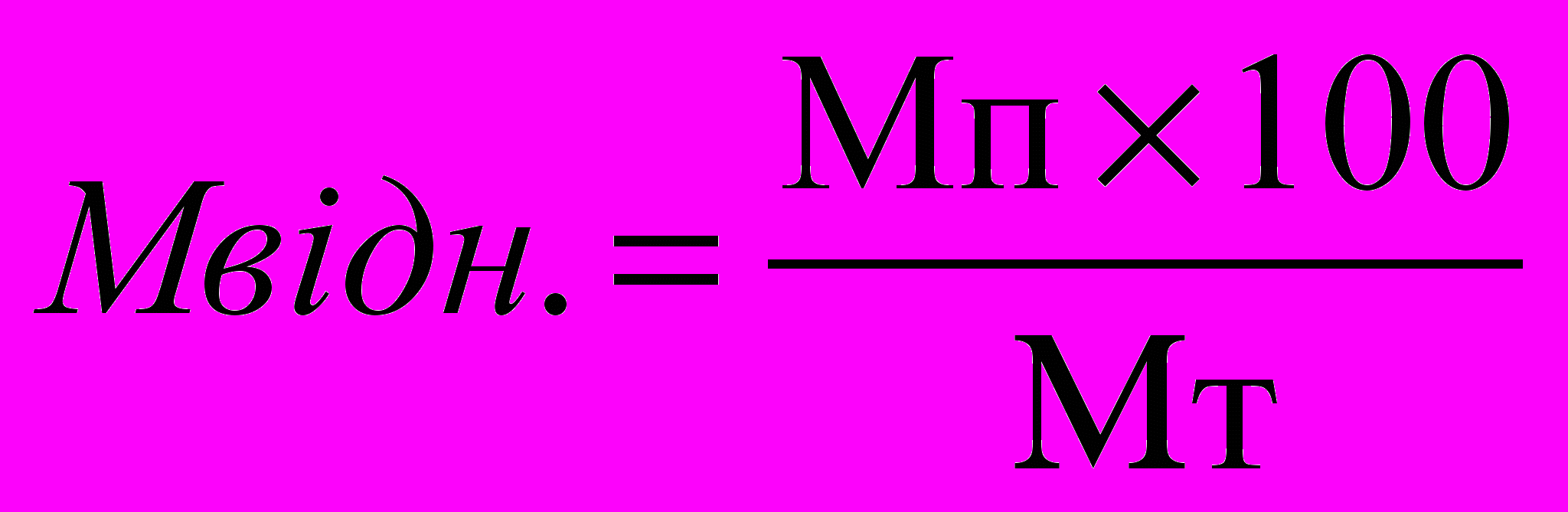 ,
,де Мвідн. – відносна маса печінки, Mп – маса печінки даного щура, Мт – маса тіла даного щура.
2. Лінійні розміри печінки (довжина, ширина, товщина) визначали за допомогою штангенциркуля з точністю до 0,1 мм.
3. Гістологічне дослідження. Печінку фіксували в 10% розчині нейтрального формаліну, промивали проточною водою, дегідратували в спиртах зростаючої концентрації та занурювали у парафін. На санному мікротомі виготовлялися зрізи товщиною 5-7 мкм. Препарати забарвлювали гематоксилін – еозином.
4. Морфометрію гістопрепаратів печінки проводили за допомогою світлового мікроскопа „Олімпус” з цифровою відеокамерою та пакетом прикладних програм „Видео Тест 5,0” та „Видео размер 5,0”. Зображення зберігали на вінчестері з наступним друком кольорових ілюстрацій.
5. Електронно-мікроскопічне дослідження. Тканину печінки розміром 1 мм2 занурювали в 1% забуферений розчин чотириокису осмію при температурі 40С. Після фіксації тканину промивали у буферному розчині і проводили дегідратацію в спиртах зростаючої концентрації та ацетоні. Потім її укладали в суміш епоксидних смол за загальноприйнятою методикою. Ультратонкі зрізи одержували на ультрамікротомі УМПТ-6, контрастували цитратом свинцю і переглядали на електронному мікроскопі ЕВМ-100 БР гепатоцити і ретикулоендотеліоцити.
6. Визначення хімічного складу. Зважену печінку від даної групи закривали у сушильній шафі при температурі 1050С і висушували до постійної ваги. За різницю у вазі вологої і сухої печінки визначали кількість води. Потім висушену тканину спалювали в порцелянових тиглях у муфельній печі при температурі 4500С протягом 48 годин. Шляхом зважування золи вираховувалася загальна кількість мінеральних речовин, а за різницею у вазі сухої печінки і попелу – кількість органічних речовин. Отриманий попіл розчиняли в 10% соляній кислоті і доводили бідистильованою водою до визначеного об’єму. На атомному абсорбційному спектрофотометрі С-115М1 за загальноприйнятою методикою визначали кількість міді (довжина хвилі – 324,7 нм), цинку (довжина хвилі – 213,9 нм), хрому (довжина хвилі – 357,9 нм), свинцю (довжина хвилі – 287,3 нм) і марганцю (довжина хвилі – 279,5 нм).
Для дослідження кісток використовували наступні методики:
- Кістки зважували на аналітичних вагах з точністю до 1 мг та вимірювали штангенциркулем по методиці W. Duerst з точністю до 0,1 мм. Остеометрія для довгих трубчастих кісток включала в себе наступні показники: найбільша довжина кістки, найбільша ширина проксимального та дистального епіфізів, найбільша ширина та передньо-задній розмір середини діафізу.
- Гістологічне дослідження діафізу та епіфізарного хряща. Досліджувалися дистальні епіфізарні хрящі плечової і стегнової кісток і проксимальний - великогомілкової, за рахунок яких іде найбільший ріст кістки в довжину [39, 40]. Для цього брали ділянки кісток із епіфізів та середини діафізу, фіксували в 10% розчині нейтрального формаліну, проводили декальцинацію в розчині Трилону Б на протязі двох місяців, зневоднювали в спиртах зростаючої концентрації та заливали в целлоідин та парафін. Готували гістологічні зрізи товщиною 10-12 мкм та забарвлювали їх гематоксилін-еозином та за Ван-Гізоном.
- Морфометрія діафізу проводилася за наступними параметрами: ширина зон зовнішніх та внутрішніх генеральних пластинок, ширина остеонного шару, діаметр остеонів та їх каналів. В епіфізарному хрящі вимірювали загальну ширину зони росту та ширину зон індиферентного, проліферуючого, дефінітивного хряща та зони деструкції. Морфометрію проводили за допомогою світового мікроскопа "Олімпус" з цифровою відеокамерою та пакетом прикладних програм "Видео Тест 5,0" та "Видео размер 5,0". Зображення зберігали на вінчестері з наступним друком кольорових ілюстрацій.
- Визначення хімічного складу. Зважену кістку від даної групи закривали в сушильній шафі при температурі 105ОС і висушували до постійної ваги. За різницею у вазі вологої і сухої кістки визначали її вологість. Потім висушену тканину спалювали в порцелянових тиглях у муфельній печі при температурі 450ОС протягом 48 годин. Шляхом зважування попелу вираховувалася загальна кількість мінеральних речовин на сухий залишок. Отриманий попіл розчиняли в 10% соляній та азотній кислотах і доводили бідистильованою водою до 25 мл. На атомному абсорбційному спектрофотометрі С-115М1 за загальноприйнятою методикою визначали кількість кальцію (довжина хвилі - 422,7 нм), калію (довжина хвилі - 404,4 нм), натрію (довжина хвилі - 330,3 нм), магнію (довжина хвилі - 285,2 нм), міді (довжина хвилі - 324,7 нм), цинку (довжина хвилі - 213,9 нм), свинцю (довжина хвилі - 287,3 нм) і марганцю (довжина хвилі - 279,5 нм).
Отримані дані обробляли статистично на персональному комп'ютері із використанням пакета прикладних програм. Достовірність розходження експериментальних і контрольних даних оцінювали з використанням критерію Ст'юдента, достатньою вважали ймовірність помилки менше 5% (р<0,05).
2. Результати дослідження та їх обговорення.
2.1 Дослідження серця в умовах надмірного споживання солей важких металів
Вивчення динаміки масометричних показників сердець молодих щурів за умов дії різних комбінацій солей важких металів міді, цинку, заліза, марганцю, хрому та свинцю свідчить про загальну токсичну дію екзополютантів.
Через 1 місяць затравки екзополютантами в усіх серіях спостерігалося зменшення чистої маси серця, маси лівого та правого шлуночків (ЧМС, МЛШ і МПШ) в середньому на 6,08-12,41% (р≤0,05). Недостовірна різниця з показниками контролю спостерігалася лише у тварин I серії. Слід зауважити, що найпершим реагував на екзогенний вплив лівий шлуночок. Маса серця та його частин продовжувала зменшуватися через 2 місяці затравки солями важких металів і була значно менша за контроль через 3 місяці.
Через 2 та 3 місяці спостереження в усіх експериментальних серіях відбувалося достовірне зростання площі ендокардіальних поверхонь обох шлуночків. Максимальна різниця з контролем зафіксована на 3-му місяці спостереження і становила від 13,42% (р≤0,05) в I серії до 20,36% (р≤0,05) в III серії.
Морфометрія гістологічних препаратів сердець молодих тварин свідчила про наявність структурно-морфологічних змін у міокарді щурів усіх експериментальних серій. Ступінь змін залежав лише від терміну затравки та комбінації солей важких металів.
Відносний об'єм судинного русла міокарда молодих тварин достовірно не змінювався протягом усього експерименту, що свідчить про значні компенсаторні можливості судин у молодому віці.
Натомість відносний об'єм сполучної тканини (ВОСТ) у препаратах сердець значно зростав та мав виражену залежність від виду солей металів. Так, у I серії ВОСТ зростав на 8,54% (р≤0,05) (ЛШ) та 7,33% (р≤0,05) (ПШ) лише через 3 місяці затравки. У II та III серіях вже через 1 місяць затравки солями важких металів відбувалося збільшення ВОСТ. Ці дані свідчать про високу токсичність даних елементів. Через 3 місяці різниця з контролем становила 9,48-14,76% (р≤0,05).
Діаметр кардіоміоцитів та їх ядер (ДКМ і ДЯКМ) достовірно зменшувався в усіх серіях, характеризуючи структурно-морфологічні зміни міокарда. Причому характерним є переважання морфологічних змін у кардіоміоцитах (КМЦ) лівого шлуночка. Достовірна різниця з контролем у I серії спостерігалася лише через 3 місяці спостереження в лівих відділах серця і становила 9,55% (р≤0,05) для ДКМ.
Гістологічна картина через 3 місяці експерименту для всіх серій тварин була типовою. При забарвленні гематоксилін-еозином відмічалося зменшення розмірів КМЦ та їх ядер. Для останніх характерним був поліморфізм (округлі, штрихоподібні). Контури серцевих міоцитів були нечіткі, цитоплазма нерівномірно забарвлена, зерниста. Поперечна посмугованість нечітко виражена, місцями зникала, між м’язовими волокнами виявлялися ділянки клітинної інфільтрації. Виражені судинні розлади: стромальний та периваскулярний набряки, потовщення, набряк, клітинна інфільтрація стінки судин середнього та дрібного калібрів, звуження їх просвіту, з утворенням клітинних агрегатів. Відмічено стази крові в судинах гемомікроциркуляторного русла (ГМЦР), кількість останніх у полі зору була зменшена. Спостерігалося розростання сполучної тканини між м’язовими волокнами та в стінці судин.
Для змінам хімічного складу серця молодих щурів були притаманні особливості, що залежать від виду солей важких металів, які вводилися з питною водою. В умовах затравки солями міді, цинку та заліза відмічалося поступове зниження вмісту міді (до 34,18% (р≤0,05) через 3 місяці, яке відбувається при її підвищеному надходження в організм із водою. Цей феномен можна пояснити конкуренцією з іонами цинку та заліза, що також надходили в організм у підвищеній кількості. Натомість рівень цинку збільшувався через 3 місяці до 31,77% (р≤0,05). Вміст заліза, що додатково надходило у організм, стрімко зростав з перших термінів спостереження і через 1 місяць перевищував контроль на 63,02% (р≤0,05). Порушення метаболізму КМЦ супроводжувалося зменшенням рівня марганцю, вміст якого був менший за контрольні показники через 3 місяці на 14,29% (р≤0,05). Динаміка вмісту натрію вказувала на порушення функціонування Na-K- насоса і характеризувалася зменшенням його рівня через 1 та 2 місяці на 7,92% (р≤0,05) та 11,00% (р≤0,05) і зростанням на 38,21% (р≤0,05) через 3 місяці. Вміст калію та кальцію в цей термін перевищував контрольні показники на 15,09% (р≤0,05) і 18,26% (р≤0,05).
Затравка солями міді, марганцю та свинцю призводила до їх акумуляції в міокарді. Їх рівень перевищував контроль відповідно на 56,82% (р≤0,05), 93,16% (р≤0,05) та 113,06% (р≤0,05) через 3 місяці спостереження. Зростання іонів міді супроводжувалося зменшенням вмісту цинку на 32,05% (р≤0,05), а збільшення вмісту марганцю і свинцю - зменшенням магнію на 54,06% (р≤0,05), що можна пояснити їх антагоністичними відношеннями. Рівень натрію та калію був менший за контроль на 42,32% (р≤0,05) та 15,08% (р≤0,05), а вміст кальцію більший за контроль на 32,28% (р≤0,05).
Таким чином, у щурів молодого віку затравка солями міді, цинку та заліза достовірно викликала структурну перебудову міокарда через 2 місяці експерименту, а у щурів, що отримували солі цинку, хрому, свинцю та міді, марганцю, свинцю – вже через 1 місяць. Структурні зміни та порушення хімічного складу серця були більш виражені у тварин III серії.
Масометрія сердець щурів зрілого віку в умовах експериментальних мікроелементозів свідчила про більші компенсаторні можливості тварин даної вікової групи (рис. 1).
Так, перший місяць спостереження характеризувався компенсаторною реакцією міокарда, яка проявлялася в його гіпертрофії. ЧМС в даний термін перевищувала контроль в усіх серіях на 7,93% (р≤0,05) - 9,54% (р≤0,05). МЛШ зростала відповідно на 8,17% (р≤0,05) - 12,08% (р≤0,05), збільшення МПШ на 6,42% (р≤0,05) було достовірним тільки в II серії. Для всіх серій характерним було зростання СІ через 1 місяць спостереження відповідно на 8,31% (р≤0,05), 10,29% (р≤0,05) та 13,03% (р≤0,05). Площі ендокардіальних поверхонь залишалися незмінними у всіх серіях.
Через 2 місяці затравки солями цинку, хрому, свинцю та міді, марганцю, свинцю відмічалася структурна перебудова міокарда, яка характеризувалася зниженням всіх масометричних показників. Так, ЧМС у тварин відповідно II та III серій зменшувалася в цей термін на 5,92% (р≤0,05) та 9,44% (р≤0,05) та знижувалася через 3 місяці на 11,72% (р≤0,05) та 16,07% (р≤0,05), що відповідає рівню змін у тварин молодого віку. МЛШ через 2 місяці була менша за контроль відповідно на 8,57% (р≤0,05) та 11,72% (р≤0,05), через 3 місяці - на 14,51% (р≤0,05) та 17,51% (р≤0,05). МПШ у тварин зрілого віку через 2 місяці експерименту достовірно зменшувалася. Різниця з контролем становила у II серії 5,94% (р≤0,05), у III серії - 7,09% (р≤0,05), зменшуючись через 3 місяці на 6,93% (р≤0,05) та 10,22% (р≤0,05) відповідно. Достовірна різниця маси серця та його частин у тварин I серії відмічалася лише на 3-му місяці затравки та становила для ЧМС - 6,21% (р≤0,05), МЛШ - 9,21% (р≤0,05). СІ у тварин всіх серій через 2 та 3 місяці спостереження залишався на рівні контролю, що відбувалося за рахунок зменшення маси тіла експериментальних тварин.
Рис. 1. Зміни масометричних показників серця щурів зрілого віку за умов затравки солями важких металів.
Площі ендокардіальних поверхонь через 2 місяці спостереження зростали, але достовірна різниця з контролем відмічалася тільки у тварин II та III серій. Так, ПСЛШ збільшилася відповідно на 9,97% (р≤0,05) та 13,78% (р≤0,05) через 2 місяці та на 14,53% (р≤0,05) та 18,25% (р≤0,05) через 3 місяці. Подібна різниця ПСПШ становить 7,54% (р≤0,05) та 10,03% (р≤0,05) через 2 місяці і 9,81% (р≤0,05) та 13,79% (р≤0,05) через 3 місяці спостереження. Подібні зміни разом зі зменшенням маси серця характеризують зрив механізмів компенсації та структурну перебудову міокарда з дилятацією порожнин серця.
Морфометрія гістологічних препаратів сердець тварин зрілого віку характеризувала гіпертрофію міокарда через 1 місяць затравки та поступовий розвиток структурно-морфологічних змін у подальші терміни спостереження.
Один місяць затравки екзополютантами призводив до зменшення об`єму судинного русла та сполучної тканини у міокарді лівого шлуночка тварин, які отримували солі цинку, хрому та свинцю відповідно на 5,93% (р≤0,05) та 6,89% (р≤0,05). Подібні показники за умов затравки солями міді, марганцю та свинцю зменшувалися в обох шлуночках. Різниця з контролем для лівих відділів серця становила відповідно 7,02% (р≤0,05) та 8,50% (р≤0,05), для правих - 5,38% (р≤0,05) та 7,11% (р≤0,05). Зменшення ВОС і ВОСТ у даний термін відбувалося вірогідно за рахунок гіпертрофії кардіоміоцитів.
Розвиток структурно-морфологічних змін у міокарді супроводжувався зменшенням розміру клітин та їх ядер, що набував найвищого ступеня через 3 місяці спостереження. Так, в цей термін ДКМЛШ та ДЯКМЛШ у тварин I серії зменшувалися на 8,25% (р≤0,05) та 6,43% (р≤0,05). Розміри клітин та їх ядер у правому шлуночку зменшувалися недостовірно. Аналогічні показники у тварин II та III серій зменшувалися відповідно на 8,33% (р≤0,05) та 6,59% (р≤0,05) і на 13,41% (р≤0,05) та 8,63% (р≤0,05). Діаметр клітин правого шлуночка також достовірно зменшувався, але ступінь змін був дещо менший, ніж у лівих відділах серця.
На відміну від тварин молодого віку, у зрілих щурів спостерігалося зменшення об`єму судинного русла, що свідчить про його більшу вразливість у тварин даного віку.
Гістологічна картина через 2 місяці експерименту характеризувалася розвитком структурно-морфологічних змін в КМЦ: в одному полі зору поряд із гіпертрофованими та КМЦ нормальних розмірів виявлялися клітини зі зменшеними діаметрами. У порівнянні кількість останніх у полі зору в III серії була найбільша. Ядра серцевих міоцитів теж відрізнялися різними розмірами і формою (округлі, витягнуті, штрихоподібні), траплялися пікнотично змінені ядра. Контури КМЦ були нечіткі, цитоплазма нерівномірно забарвлена, зерниста, поперечна посмугованість нечітко виражена, місцями зникала. Судинні розлади, які характеризувалися явищами стромального та периваскулярного набряків, розширенням та повнокров'ям судин різного калібру, капіляростазами та крововиливами, були теж більше виражені в II та III серіях. При подовженні терміну експерименту наростали структурно-морфологічні зміни міокарда, які характеризувалися порушенням орієнтації м’язових волокон, ділянками їх фрагментації. КМЦ у полі зору були переважно морфологічно змінені: контури клітин нечіткі, цитоплазма нерівномірно забарвлена зерниста, поперечна посмугованість місцями не візуалізувалася. Ядра зазначених клітин поліморфні, з розмитими контурами, траплялися пікнотично змінені ядра.
Хімічний склад серця піддослідних тварин характеризувався змінами, подібними до тварин молодого віку. Це характеризує універсальність компенсаторно-пристосувальних процесів у міокарді тварин усіх вікових груп на дію екзогенних чинників.
Таким чином, затравка солями важких металів тварин зрілого віку всіх серій веде до розвитку компенсаторної гіпертрофії міокарда, яка є проявом адаптації серця до дії несприятливих факторів. При подовженні терміну експерименту у тварин відбувався зрив компенсаторно-пристосувальних механізмів, який проявлявся у структурній перебудові міокарда щурів I серії експерименту через 2 місяці спостереження, у щурів II та III серій - через 1 місяць. Найбільш виражені структурно-метаболічні зміни міокарда щурів зрілого віку спостерігалися у тварин, які отримували у підвищеній кількості солі міді, марганцю та свинцю протягом 3 місяців.
Масометричні показники сердець тварин старечого віку характеризували структурну перебудову міокарда, що розвинулася вже через 1 місяць після початку затравки важкими металами. У тварин даної вікової групи відбувався швидкий розвиток структурної перебудови міокарда разом із дилятацією порожнин, що не є характерним для інших вікових груп.
Морфометрія міокарда тварин старечого віку характеризувалася зменшенням ДКМ та їх ядер і зростанням відносного об`єму сполучної речовини, починаючи з перших термінів спостереження.
Так, у тварин I серії ДКМЛШ зменшувався на 6,77% (р≤0,05) разом із ДЯКМПШ, що був менший за контроль на 6,21% (р≤0,05). Різниця з контролем стрімко збільшувалася, і через 3 місяці ДКМЛШ знижувався на 9,83% (р≤0,05), ДЯКМЛШ - на 9,15% (р≤0,05). Аналогічні показники правого шлуночка були менші за контроль відповідно на 9,09% (р≤0,05) та 7,14% (р≤0,05).
Морфометрія гістопрепаратів сердець тварин II та III серій свідчила про стрімкий розвиток морфологічних змін у міокарді вже через 1 місяць спостереження. Продовження терміну затравки екзополютантами призводило до значного зменшення розмірів м`язових клітин та їх ядер. Через 3 місяці ДКМЛШ у другій серії тварин зменшився на 12,79% (р≤0,05), ДЯКМЛШ - на 9,50% (р≤0,05); у третій серії - відповідно на 21,08% (р≤0,05) та 15,92% (р≤0,05). ДКМПШ зменшився відповідно на 12,04% (р≤0,05) та 18,33% (р≤0,05), ДЯКМПШ - на 8,72% (р≤0,05) та 13,71% (р≤0,05).
Відносний об`єм сполучної тканини міокарда збільшувався залежно від терміну затравки та комбінації солей важких металів і набував найбільшого ступеня через 3 місяці спостереження. У цей термін ВОСТ у тварин I серії зростав на 9,73% (р≤0,05) у ЛШ та на 8,56% (р≤0,05) у ПШ; у II серії - на 13,73% (р≤0,05) та 11,52% (р≤0,05) і на 18,91% (р≤0,05) та 17,54% (р≤0,05) відповідно в III серії.
При світлооптичному вивченні гістологічних препаратів шлуночків серця тварин старечого віку, що затравлювалися солями важких металів протягом 1 місяця, в одному полі зору виявлялися КМЦ різних розмірів: нормальні, зменшені та поодинокі гіпертрофовані, з нерівномірно забарвленою зернистою цитоплазмою, нечітко вираженою поперечною посмугованістю. Спостерігалися зміни з боку судин: стромальний та периваскулярний набряк, повнокров'я дрібних та судин середнього калібрів, розширення судин МЦР, крововиливи. При подовженні експерименту наростали морфологічні зміни: спостерігалося розволокнення, ділянки фрагментації м’язових волокон; КМЦ із зернистою нерівномірно забарвленою цитоплазмою. Поперечна посмугованість майже повністю зникала. Ядра цих КМЦ теж були зменшені, поліморфні, траплялися ядра в стадії пікнозу. Відмічалися більш виражені судинні розлади, які характеризувалися явищами стромального та периваскулярного набряків, потовщенням, набряком стінок артерій, звуженням просвіту судин. Кількість судин ГМЦР у полі зору була зменшена. Спостерігалося значне розростання в судинній стінці та між м’язовими волокнами сполучної тканини.
Хімічний склад серця тварин старечого віку характеризувався змінами, які були притаманні тваринам попередніх вікових груп. Однак, на відміну від них відмічалося значне накопичення екзогенних мікроелементів та зменшення рівнів ендогенних.
В умовах споживання солей міді, цинку та заліза вміст останніх двох зростав через 3 місяці відповідно на 44,79% (р≤0,05) та 68,34% (р≤0,05) на фоні зменшення міді на 41,24% (р≤0,05). Характерним було також зменшення рівня марганцю на 16,88% та збільшення кальцію на 21,60% (р≤0,05) (рис. 2).
Рис. 2. Відсоткове співвідношення хімічного складу серця щурів різного віку за умов затравки солями міді, марганцю та свинцю протягом 3 міс.
Через 3 місяці спостереження в міокарді тварин II серії вміст цинку, хрому та свинцю зростав на 69,04% (р≤0,05), 61,88% (р≤0,05) та 75,26% (р≤0,05). При цьому рівень міді, марганцю та заліза зменшувався на 53,69% (р≤0,05), 22,18% (р≤0,05) та 24,38% (р≤0,05). У тварин III серії вміст міді, марганцю та свинцю значно зростав і перевищував контроль через 3 місяці відповідно на 73,99% (р≤0,05), 112,54% (р≤0,05) та 165,01% (р≤0,05). Рівень цинку, заліза та магнію в даний термін був менший за показники контролю відповідно на 42,78% (р≤0,05), 21,08% (р≤0,05) та 72,11% (р≤0,05).
Універсальною реакцією на екзогенний вплив була зміна вмісту натрію, калію та кальцію. Різниця між віковими групами та комбінацією солей важких металів полягала у ступені зміни рівнів цих елементів. Так, у тварин старечого віку в терміни 1 та 2 місяці затравки рівні натрію та калію поступово зменшувалися, але стрімко зростали на 3-му місяці спостереження. Натомість вміст кальцію поступово збільшувався та через 3 місяці був вищий за контроль відповідно на 21,60%, 22,83% та 39,81%.
Таким чином, у групі тварин старечого віку в умовах експериментальних мікроелементозів спостерігався швидкий розвиток структурних змін міокарда вже в кінці першого місяця експерименту та накопичення солей важких металів у найбільших концентраціях порівняно з іншими віковими групами, в тканинах серця, що свідчить про зниження компенсаторно-пристосувальних процесів, швидкості обміну речовин, а саме мікро- і макроелементів у серці з віком. Найбільш виражена структурна перебудова міокарда, дилятація порожнин серця та порушення хімічного складу виявлені у щурів старечого віку, які затравлювалися солями міді, марганцю і свинцю протягом 3 місяців.
2. 2 Дослідження нирок в умовах дії малих доз радіації та солей важких металів.
При аналізі нирок тварин першої серії експерименту визначено, що при дозах 0,1 і 0,2 Гр в їх паренхімі спостерігаються незначні морфофункціональні зміни структурних компонентів нефрона, які проявляються збільшенням в розмірах деяких ниркових тілець, що недостовірно більше такого показника у інтактних тварин на 0,1-2,5 %. Також порівняно з контролем зменшується площа судинних клубочків на 0,2-1,7 %, та збільшуеться площа просвіту капсули Шумлянського-Боумена.
На світлооптичному рівні в групі R1, ми не встановили достовірних відмінностей загальних рис структури нефрону, кровоносних капілярів судинного клубочка та перитубулярної системи. Але із збільшенням дози до 0,2 Гр спостерігається незначне наростання структурних змін. Ступінь ураження і протяжність змінених ділянок неоднакова в різних відділах канальців, що вказує на синхронне втягнення їх у патологічний процес. Певно, це залежить від функціональних особливостей різних відділів нефрону, чутливості до наростання дози опромінення, а також послідовності включення запасних, резервних нефронів у компенсаторно-пристосувальні реакції. На субклітинному рівні реакція компонентів фільтраційно-реабсорбційного барьеру більш значна. Вже при опроміненні в дозі 0,1 Гр знайдені нами зміни фільтраційного бар’єру нирок вказують на розвиток в них функціонального навантаження, за рахунок активації захистно-адаптаційних реакцій органу. Морфологічно це проявляється збільшенням ядер ендотеліоцитів клубочкових капілярів, зміною рельєфу зовнішніх контурів за рахунок інвагінації каріолеми. Відбувається потовщення периферичної частини ендотеліальних клітин, розширюються цистерни гранулярної ендоплазматичної сітки. Поряд з тим спостерігаються явища гіпертрофії органел у подоцитах вісцерального листка капсули ниркового тільця. Ядра набряклі з вираженими інвагінаціями каріолеми. Профілі гранулярної ендоплазматичної сітки і апарату комплексу Гольджі розширені. Мітохондрії набряклі з матриксом середньої електронної щільності і невеликою кількістю крист. Дані наших досліджень певною мірою можна співставити з даними інших дослідників, які експериментально вивчали поетапність реакцій внутрішніх органів на екстремальні чинники зовнішнього середовища (41). Результати роботи, які ми одержали навіть після опромінення в дозі 0,1 Гр, розширюють і доповнюють дані багатьох дослідників.
При збільшенні вдвічі дози опромінення спостерігаються більш суттєві зміни клітинних і неклітинних компонентів реабсорбційного бар’єру. Виникає перебудова внутрішніх структур клітин, що проявляється збільшенням кількості мітохондрій, мікропіноцитозних пухирців, вакуолей, набряком і збільшенням їх крист, розширенням профілів гранулярної ендоплазматичної сітки і апарату комплексу Гольджі. Все це свідчить про подальше напруження адаптаційно-захистних механізмів, морфологічним еквивалентом якого є явища гіперплазії і гіпертрофії внутрішньоклітинних структур.
При опроміненні піддослідних тварин в дозі 0,1 і 0,2 Гр спостерігається зниження, в порівнянні з контролем, вмісту води, органічних речовин та мікроелементів нирки. Так, вміст свинцю знижується на 10,2-10,5 %, кількість хрому стає меншою на 16,2-28,2 %, марганцю – на 20,1-41,5 %, цинку – на 44,7-55,3 %, води – на 23,9-28,3 % при загальному збільшенні мінерального компоненту на 42,0-50,1 %. При чому, на відміну від морфометричних показників, зміни хімічного складу статистично достовірні, що підтверджує дані ряду авторів (42, 43) про першочергову реакцію обміну клітин на дію екологічних чинників, які потім стають пусковим механізмом подальших морфофункціональних перетворень.
Світлооптичні, морфометричні та електронномікроскопічні дослідження показали, що в умовах опромінення в дозі 0,3 Гр відбуваються найбільш виражені зміни всіх компонентів нефрона, при чому переважають дистрофічні зміни над пристосувально-компенсаторними. Гістологічно визначається різний морфофункціональний стан і поліморфізм ниркових тілець. Рідко зустрічаються атрофовані ниркові тільця, проте багато гіпертрофованих. Одні ниркові тільця мають помірні розміри, збільшені просвіти капсули Шумлянського-Боумена, інші – зменшені за розміром, поодинокі, в яких чітко спостерігається ущільнення судинного клубочка і виразне збільшення просвіту капсули. Глибина і поширеність пошкодження залежить від морфофункціональних спеціалізованих епітеліоцитів різних відділів нефрону і більш зміненими виявляються проксимальні відділи, як найспеціалізованіші і функціонально напружені ділянки канальцевої системи. В епітелії канальців змінюються їх плазматичні мембрани, при чому дистрофії піддається апікальна частина клітин, що містить мікроворсинки. Дистрофічні зміни виникають також в базальній частині, де зникає базальна посмугованість. В гіпертрофованих ниркових тільцях середня площа перерізу збільшується на 4,7 % і складає 4186 + 121 мкм2, площа судинного клубочка – на 4,3 % і площа просвіту капсули Шумлянського-Боумена – на 6,5 %. Площа атрофованих ниркових тільцях зменшується на 7,4 %, площа клубочка – на 5,5 % і площа просвіту капсули – на 16,2 % .Розширені на 9,2 % діаметри просвіту проксимальних звивистих канальців нефрона мають збільшену площу просвіту на 17,7 %, діаметр канальців збільшується на 5,7 % і складає 35,20 + 0,40 мкм, а площа канальців збільшується на 11,0%, що є достовірним по відношенню до інтактних тварин. Висота епітеліоцитів збільшується на 1,8 % , а ширина клітин проксимальних звивистих канальців нефрона помірно звужується на 4,7 % і дорівнює 10,33 + 0,36 мкм, внаслідок чого площа епітеліоцитів зменшується на 3,0 %. Площа ядер зменшується на 15,3 % (22,98 + 0,57 мкм2), а діаметр ядра – на 8,0 %. Епітеліоцити дистального відділу звивистих канальців нефрона мають висоту, збільшену на 11,5 %, а ширину – на 3,9 % , при цьому площа клітин збільшується на 14,9 % . Площа ядер достовірно зменшується на 12,3 %, а діаметр – на 6,4 %. Діаметр дистального звивистого канальця нефрона збільшується на 7,9 %, а його площа – на 15,2 %. Незначно збільшується діаметр просвіту канальця на 5,3 % , а площа просвіту – на 10,4 %.
При дії опромінення в дозі 0,3 Гр з’являються ознаки порушення клубочковаї фільтрації, що свідчить про пошкодження гломерулярного фільтру, основою якого можна вважати зміни ультраструктури клубочка (44, 45). Відмічається набряк і просвітлення цитоплазми ендотеліоцитів, з наявністю значної кількості мікропіноцитозних пухирців. Люменальна мембрана місцями стає нечіткою, має інвагінації і випинання. Ядра ендотеліоцитів збільшені за розмірами, каріолема їх має хвилястість зовнішніх контурів. Апарат комплексу Гольджі представлений сплощеними пухирцями і цистернами. Розширена гранулярна ендоплазматична сітка. Подоцити збільшені за розмірами, мають витягнуту форму, ядра їх набряклі, каріолема з неглибокими інвагінаціями. Апарат Гольджі з великими везикулами і цистернами, які обмежені гладкими мембранами. Цитотрабекули містять незначну кількість вакуолей і пухирців. Подекуди прослідковується тяж, утворений злиттям суміжних цитоподій. Так в епітеліоцитах проксимальних звивистих канальців нефрону відмічається деформація і набряк мікроворсинок щіточкової облямівки, біля основи якої міститься значна кількість мікровезикул. Цистерни гранулярної ендоплазматичної сітки розширені з поодинокими рибосомами на їх мембранах. Ядра клітин неправильної форми з інвагінаціями каріолеми. Спостерігається зменшення складчастості базальної плазматичної мембрани. Ультраструктурний аналіз дистальних звивистих канальців нефрона вказує на напруження функціонального стану епітеліоцитів. Перинуклеарний простір збільшений, апарат Гольджі представлений великими пухирцями і вакуолями. Мітохондрії в різному морфологічному стані, кристи їх укорочені, деформовані. Подекуди проходить гомогенізація матриксу і зникнення крист. Базальна мембрана гомогенізована, нерівномірно потовщена, зменшена в базальній частині її складчастість.
Аналіз електронномікроскопічних змін в кірковій речовині нирок при опроміненні в дозі 0,3 Гр вказує на злоякісніший перебіг вісцеральних пошкоджень, що спостерігається навіть на початкових стадіях променевої хвороби (46, 47).
Найбільш суттево змінюється хімічний склад нирок під впливом опромінення в дозі 0,3 Гр. Абсолютно достовірно зменшується вміст свинцю на 11,3 %, цинку – на 61,2 %, марганцю – на 62,4 %, хрому – на 39,5 %, міді – на 57,6 %, відносно відповідних показників контрольної групи тварин. Вологість нирки стає меншою на 35,6 %, при зростанні вмісту неорганічних речовин на 55,5 %.
Таким чином, під впливом опромінення в низьких дозах в паренхімі нирок відбуваються гіпертрофічно-гіперпластичні перетворення, які із збільшенням дози радіації перетворюються на дистрофічно-атрофічні (48, 49). Першими індикаторами цих зрушень є дестабілізація іонного обміну біологічноактивних хімічних речовин та зміни в тубулярній і базальній мембранах стінки мікроциркуляторного русла. В епітеліальних клітинах найбільш чутливим є апарат Гольджі та мітохондрії, порушення яких впливає на ультраструктуру всіх органел.
В другій серії експерименту, де тварини вживали воду з підвищеним вмістом солей міді, хрому, марганцю, цинку, та свинцю протягом 1, 2, та 3-х місяців, світлооптичні, морфометричні і електронномікроскопічні дослідження довели про однотипність реакції фільтраційно-реабсорбційного бар’єру нирок на опромінювання та зловживання солями важких металів. Це підтверджуює дані деяких дослідників (50, 51). Кількісні морфометричні та хімікоаналітичні зміни структури нирок під впливом хімічних забруднювачів в середньому на 10-15 % перевищують аналогічні показники опромінених тварин. Природньо, що із збільшенням строків навантаження солями важких металів ці зміни суттєво зростають. Спостерігається поліморфізм ниркових тілець. В основному, присутні гіпертрофовані ниркові тільця, але зустрічаються і атрофовані, особливо при 3-х місячному строці експерименту. Судинні клубочки через місяць вживання солей ще структуруються добре, а через два і три місяці у більшості ниркових тілець спостерігаються зруйновані структури. Морфометричний аналіз гіпертрофованих ниркових тілець свідчить про збільшення їх середньої площі на 5,3 %, площі судинного клубочка – на 4,5 %, площі просвіту капсули Шумлянського-Боумена – на 9,3 %. В атрофованих ниркових тільцях площа зменшується на 5,1 %, площа судинних клубочків – на 5,8 %, а площа просвіту капсули – на 0,7 %. В нефротелії більшості проксимальних звивистих канальців нефрону із збільшенням терміну експеримента все чіткіше проявляються ознаки атрофії. Епітеліоцити мають прояснену цитоплазму, особливо в канальцях, розташованих в зовнішніх відділах кіркової речовини нирок. У просвіті більшості проксимальних канальців нефрону знаходять різко оксифільні гомогенні або пластівчасті маси. У тварин зі строками навантаження солями важких металів 2 і 3 місяця виявляється оксифільна зернистість, нечіткість між клітинами епітеліоцитів, особливо їхньої апікальної частини. Ядра дрібні, гіперхромні, чи слабо забарвлюються. Морфометричний аналіз виявив достовірне зменшення ядер на 2,6-9,6 %, а їх площі на 5,0-18,2 %, відносно показників контролю. Висота епітеліоцитів звивистих канальців нефрону зменшується на 2,5 % (в групі С3), ширина – на 1,6-6,3 %, а площа – на 8,7 % (в групі С3). Діаметр канальця проксимальної частини нефрону збільшується на 2,6-6,3 %, а його площа на 5,2-12,2 %, діаметр просвіту канальців та їх площа достовіроно стають більшими на 0,9-13,6 % і 1,8-25,4 %, відповідно. Епітеліоцити дистального відділу звивистих канальців нефрону мають площу, збільшену на 9,3-16,3 %, висоту – на 8,1-10,9 %, а ширину на 1,2-6,0 %. Ядра клітин зменшуються в діаметрі на 2,1-7,8 %, а їх площа стає меншою на 4,1-14,9 %. Діаметр канальців дистального відділу нефрона збільшується на 3,6-8,5 %, а середня площа їх перерізу – на 7,1-16,2 %. Також збільшується і діаметр просвіту на 0,3-6,7 %, а площа просвіту – на 0,7-13,0 %. Як бачимо, різниця з порівнювальним контролем збільшується пропорційно строкам затравлення солями важких металів. І найбільш суттєві і достовірні перетворення структурних елементів нефрона відбуваютья при навантаженні солями важких металів протягом 3-х місяців. Ультрамікроскопічні дослідження ниркових тілець кіркової речовини нирок щурів групи С1 свідчать про незначне відхилення від показників норми. Наявні розширені канальці гранулярної ендоплазматичної сітки та цистерни комплексу Гольджі. Для ендотеліоцитів гемокапілярів характерна виражена фенестрація. В цитоплазмі наявні вакуолі, розширені цистерни комплексу Гольджі, базальна мембрана нерівномірно потовщена. Епітеліоцити проксимального відділу нефрону майже не змінені. Плазмолема базальної частини має складки мембрани, між якими розміщені частково гіпертрофовані мітохондрії з просвітленим матриксом. Епітеліоцити дистальних звивистих канальців нефрону мають глибокі складки плазмолеми та паралельно розміщені до них мітохондрії. В апікальній частині зменшується кількість органел.
Електронномікроскопічні дослідження в групі тварин, що отримувала солі важких металів протягом 2-х місяців (С2), показали значні зміни компонентів фільтраційного бар’єру. Спостерігається потовщення ендотеліальної вистілки клубочкових капілярів з появою на окремих ділянках плазмолеми цитоплазматичних випинань, обернутих у просвіт капілярів. Мітохондрії набряклі, з просвітленим матриксом і частково редукованими кристами. Гранулярна ендоплазматична сітка представлена поодинокими розширеними цистернами. У більшості подоцитів клубочкових капілярів ядра неправильної форми з вираженими інвагінаціями. На розширених цистернах і канальцях гранулярної ендоплазматичної сітки зменшується кількість рибосом. Мітохондриальний матрикс слабкої електронної щільності з невеликою кількістю крист. В епітеліоцитах проксимальних звивистих канальцях нефрону відмічається деформація мікроворсинок щіточкової облямівки, місцями виражений їх набряк. У плазмолемі утворюються неглибокі інвагінації. В апікальній частині клітин збільшується кількість піноцитозних пухирців і вакуолей. Зовнішні контури ядер епітеліоцитів з невеликими інвагінаціями каріолеми. Перинуклеарний простір розширений. Зустрічаються гіпертрофовані мітохондрії з фрагментованими кристами і гомогенізацією матриксу. В дистальних звивистих канальцях нефрону в апікальній частині епітеліоцитів визначається невелика кількість коротких мікроворсинок. Перинуклеарно розташований апарат Гольджі, представлений розширенними цистернами. Мітохондрії збільшені за розмірами, матрикс їх просвітлений, кристи фрагментовані. Складки цитоплазматичної мембрани вкорочені і розширені.
І, накінець, в групі тварин С3 електронномікроскопічно явища функціонального перенапруження наростають. Спостерігається фрагментація мембран органел ендотеліоцитів, клубочкових капілярів, потовщення і розмитість їх базальної мембрани. У периферійній частині вікончастих ендотеліоцитів збільшується кількість фенестр і пор. Характерною ознакою є поява в цитоплазмі подоцитів мієліноподібних структур, деформація цитотрабекул і цитоподій. Наявна дезінтеграція гранулярної ендоплазматичної сітки і апарату комплексу Гольджі. Мітохондрії набряклі з просвітленим матриксом і редукованими кристами. В епітеліоцитах проксимальних звивистих канальців нефрону наявна десквамація мікроворсинок щіточкової облямівки, руйнування клітинної мембрани. Частина мікроворсинок зміщена у просвіт канальця. Ядра цих клітин набряклі, деформовані, займають апікальне положення. Гранулярна ендоплазматична сітка дезорганізована. Цистерни апарату комплексу Гольджі розпадаються на дрібні пухирці. В епітеліоцитах дистальних звивистих канальців нефрону виявлено дезорганізацію поверхні клітин. В їх апікальній частині спостерігаються вакуолі, що вказує на розвиток гідратації цитоплазми. В нуклеоплазмі наявні вогнища просвітлення. Гранулярна ендоплазматична сітка трансформується в незернисту. Спостерігається розпад сплошених мішечків, які утворюють диктіосоми апарату комплексу Гольджі. Мітохондрії набряклі із зруйнованими кристами. Наявні ділянки плазмолеми з глибокими інвагінаціями в цитоплазму.
Отже, 3-х місячне вживання надмірної кількості солей важких металів призводить до виснаження адаптаційно-захистних реакцій структурних компонентів фільтраційно-реабсорбційного бар’єру з декомпенсацією і розвитком в них деструктивних змін (52, 53). На відміну від першої серії експерименту, де під впливом опромінення кількість біологічноактивних елементів в нирках знижується, в даній серії експерименту, природньо, у зв’язку з надходження їх ззовні у великій кількості, вміст міді збільшений на 22,7-52,4 %, хрому – на 12,3-14,6 %, марганцю – на 35,1-54,9 %, цинку – на 33,3-53,6 %, свинцю – на 23,6-36,1 %, неорганічних речовин – на 61,7-68,4 %, відносно показників контрольної групи. Вміст органічних речовин знижується на 5,9-7,6 %, а вологість зменшується на 12,3-25,4 %.
Таким чином, затравка щурів солями важких металів протягом 1, 2 і 3-х місяців призводить до напруження компенсаторних механізмів нефронів, що проявляється явищами гіпертрофії і гіперплазії внутрішньоклітинних структур. При збільшенні терміну вживання солей проходить зрив адаптації і розвиток деструктивних змін в кірковій речовині нирок.
В третій серії експерименту, де моделювався комбінований вплив двох чинників – опромінення в дозі 0,1, 0,2 і 0,3 Гр в комбінаціїї з вживанням солей важких металів протягом 1, 2 і 3-х місяців, з’ясували, що шкідливі чинники екології накладалися один на другий, викликаючи сумарний негативний ефект. Комбінована дія підвищених доз радіації та затравка солями важких металів в довші строки однозначно викликала більш суттєві зміни фільтраційно-реабсорбційного бар’єру кіркової речовини нирок.
Так в групі тварин R1+C1 на світлооптичному рівні ми відмічаємо лише помірне кровонаповнення ниркових клубочків, а в проксимальних звивистих канальцях нефрону – посилення базофілії. Із збільшенням дози опромінення та накопичення солей важких металів зміни фільтраційного бар’єру, які тісно пов’язані з базальною мембраною капілярів, визначаються більш наочно. Ця базальна мембрана стає гомогенною, осміофільною, втрачає свою тришарову будову. Судинні клубочки зморщуються, просвіти капсули Шумлянського-Боумена розширюються. В подальшому все частіше зустрічаються атрофовані ниркові тільця зі зменшими атрофованими судинними клубочками. По мірі зростання комбінованого впливу в проксимальній частині звивистих канальців нефрону все краще спостерігаються явища дистрофії. Цитоплазма епітеліоцитів просвітлюється, в ній все частіше зустрічаються поодинокі дрібні зерна. Ядра клітин поступово зменшуються, все гірше сприймають барвник. Об’єм цитоплазми збільшується, а просвіт канальців розширюється. Нерідко верхівкові межі епітеліоцитів розмиті, спостерігається руйнування ендотелію капілярів на окремих ділянках, розширення просвіту дрібних артеріальних судин. Морфометричні дослідження проксимальних звивистих канальців нефрону засвідчили прогресивне збільшення площі їх просвіту. При цьому збільшується діаметр канальців, а також їх середня площа перерізу, в порівнянні з інтактними тваринами. Форма епітеліоцитів помірно сплощується за рахунок зменшення ширини клітин, при цьому площа стає все меншою (за виключенням груп R1+C1 та R2+C1, де ці показники є недостовірні). Ядра клітин та їх площа зменшуються. Розширюються поступово і дистальні звивисті канальці нефрону.
Вже в групі R1+C2 спостерігаються явища зернистої дистрофії. Щіточкова облямівка та базальна посмугованість визначаються нечітко. Із збільшенням навантаження явища зернистої дистрофії змінюються на гідропічну. Цитоплазма епітеліоцитів просвітлюється, об’єм її збільшується. Ядра клітин поступово зменшуються в розмірах, фарбуються базофільно. Зустрічаються клітини, в цитоплазмі яких ядра відсутні (R3+C2). В просвіті дистальних звивистих канальців нефрону візуалізуються незначні зернистості, ниткоподібні або пластівчасті оксифільні маси.
Ультрамікроскопічно, починаючи від групи R2+C1 і закінчуючи групою R3+C3, визначається перебудова внутрішньоклітинних структур судинного клубочка, яка в значній мірі впливає на склад ультрафільтрату. Подоцити, що складають внутрішній листок капсули Шумлянського-Боумена мають масивні цитотрабекули, від яких до базальної мембрани щільно прилягають цитоподії. Зміна конфігурації та розмірів педикул змінює кількість та величину фільтраційних щілин, що регулює проникність гломерулярного фільтру. Збільшуються ядра ендотеліоцитів клубочкових капілярів із зміною рельєфу зовнішніх контурів за рахунок інвагінації каріолеми. Відбувається потовщення периферійної частини ендотеліальних клітин, розширюються цистерни гранулярної ендоплазматичної сітки. Поряд з цим, все частіше спостерігаються явища гіпертрофії органел у подоцитах вісцерального листка капсули ниркового тільця. Ядра набряклі, з вираженими інвагінаціями каріолеми. Профілі гранулярної ендоплазматичної сітки і апарату Гольджі поступово розширюються. Мітохондрії набрякають, зменшується кількість іх крист.
Зі збільшенням впливу зовнішніх чинників у внутрішньоклітинних структурах фільтраційного бар’єру наростають явища гіпертрофії та гіперплазії, спостерігається збільшення кількості фенестр і пор в ендотеліоцитах. Виражений набряк базальної мембрани клубочкових капілярів, що вказує на відповідь компенсаторно-адаптаційних реакцій на променеву і металеву інтоксикацію.
Під впливом комбінованої дії випромінювання і солей важких металів розвиваються явища дистрофії в проксимальних і дистальних звивистих канальцях, де відбувається реорганізація клітинної поверхні епітеліоцитів та ендотеліоцитів перитубулярних капілярів. Виникає перебудова внутрішніх структур даних клітин, що проявляється збільшенням кількості мікропіноцитозних пухирців, вакуолей, набряку мітохондрій і збільшенням їх крист, розширенням профілів гранулярної ендоплазматичної сітки і апарату Гольджі, набряком ядер. Певні зміни виражені у базальних мембранах канальців і перитубулярних капілярів, що проявляється поступовим зменшенням їх електронної щільності. Всі ці зміни вказують на крайне напруження адаптаційно-захистних реакцій.
В групах тварин з найбільшим екстремальним впливом ми спостерігаємо більшу ушкоджуючу дію на компоненти клубочкової фільтрації. Спостерігається фрагментація мембран органел ендотеліоцитів клубочкових капілярів. Цитопедикули подоцитів вузькі, виглядають видовженими, місцями зникають. Внаслідок дистрофічних і деструктивних змін в цитоплазмі виявляються зони нерівномірної електронної щільності без органел, або із залишками мітохондрій. Цистерни гранулярної ендоплазматичної сітки різко збільшуються і перетворюються на великі вакуолі. Це поєднується з розширенням перинуклеарного простору і просвітленням мітохондріального матриксу та редукцією крист, що свідчить про явищя набрякання (54).
В групах тварин R2+C3 та R3+C3 спостерігаються найбільш значні зміни в структурі епітеліоцитів звивистих канальців нефрону. Мітохондрії гіпертрофовані, спостерігається важка деструкція канальців і цистерн гранулярної ендоплазматичної сітки та комплексу Гольджі. Зникає посмугованість в базальному полюсі, де розташовані лише залишки органел. Ядра епітеліоцитів майже контактують з просвітом канальців.
Таким чином, ультрамікроскопія нефронів кіркової речовини нирок тварин при комбінованому впливі опромінення і солей важких металів свідчить про дистрофічно-деструктивні процеси в нирках, які прогресують пропорційно дозі і терміну впливу екологічного чинника.
При вивченні хімічного складу нирок в третій серії експерименту звертає увагу на себе той факт, що інтенсивне виведення мікроелементів під впливом радіації з надлишком компенсується їх штучним надходженням в процесі експерименту. Тому при аналізі хімічного складу чітких тенденцій ми не спостерігаемо. Особливо це стосується вмісту свинцю, який дуже шкідливий для фільтраційно-реабсорбційного бар’єу нирок.
Таким чиним, одержані нами результати свідчать про виражений патологічний вплив на нирки опромінення в низьких дозах та вживання солей важких металів.
