Элементы квантовой механики и физики атомов, молекул, твердых тел /5 а, 5 б
| Вид материала | Лекция |
СодержаниеОпыты Резерфорда. Ядерная модель атома. Недостатки модели атома по Резерфорду. 11.3. Экспериментальное подтверждение постулатов Бора 11.4. Теория атома водорода по Бору Недостатки теории Бора. |
- Элементы квантовой физики атомов и молекул, 473.12kb.
- Элементы квантовой механики Атом Резерфорда – Бора и гипотеза де Бройля Ядерная модель, 38.71kb.
- 14. Элементы квантовой статистики и зонной теории твердого тела, 460.81kb.
- Развитие теоретической физики в ХХ веке шло под флагом зарождения, развития и становления, 110.96kb.
- Основы квантовой механики, 33.02kb.
- Программа дисциплины дпп. Ф. 02 Строение молекул и основы квантовой химии, 160.77kb.
- Рабочая программа утверждаю: по курсу общей и экспериментальной физики (основы квантовой, 73.65kb.
- Реферат Отчет 177 с., 3 ч., 199 рис., 12 табл., 72 источников, 1 прил, 33.16kb.
- Д. И. Менделеева Строение молекул и основы квантовой химии Магистерская программа, 307.43kb.
- Лекция 12. Элементы квантовой механики, 352.16kb.
Раздел 5. Элементы квантовой механики и
физики атомов, молекул, твердых тел /5 а, 5 б/
(10 часов)
Лекция 11. Атом Резерфорда – Бора и гипотеза де Бройля
11.1. Ядерная модель атома Резерфорда
Введение. В 19 веке впервые были открыты явления, обнаруживающие сложность строения и свойств атомов, которые до этого рассматривались как мельчайшие частицы вещества. Так в 1833 году М. Фарадей установил, что ток в растворе электролита – это упорядоченное движение заряженных частиц (ионов), минимальный заряд которых примерно равный е = 1,60∙10-19 Кл был назван элементарным электрическим зарядом. Поскольку в обычных условиях атомы являются электронейтральными, то естественно было предположить, что в их состав входят и какие-то положительно заряженные частицы. В 1896 году французский ученый Беккерель обнаружил явление естественной радиоактивности солей урана. Это явление исследовали Пьер и Мария Кюри, доказав, что из атомов вылетают и электроны, и положительно заряженные частицы (впоследствии названные α-частицами). На сложную структуру атомов указывали спектроскопические исследования, которые привели к открытию линейчатых спектров атомов. В начале XIX века были открыты дискретные спектральные линии в излучении атомов водорода в видимой части спектра, и впоследствии были установлены математические закономерности, связывающие длины волн этих линий (И. Бальмер, 1885 г.). В 1897 году Дж. Томсон открыл электрон и измерил отношение e/m заряда электрона к массе. Опыты Томсона подтвердили вывод о том, что электроны входят в состав атомов, причем носителями отрицательного заряда атомов являются легкие электроны, масса которых составляет лишь малую долю массы атомов. Основная часть массы атомов связана с положительным зарядом.
В первой модели атома Дж. Томсона (1903 г.) атом рассматривался как заполненный положительным электричеством шар, внутри которого находились электроны. Атом в целом был электронейтрален. Однако в дальнейшем выяснилась несостоятельность этой модели.
Опыты Резерфорда. Эксперименты по исследованию внутренней структуры атомов впервые были выполнены Э. Резерфордом c сотрудниками в 1909–1911 годах. Резерфорд предложил применить зондирование атома с помощью α-частиц, которые возникают при радиоактивном распаде радия и некоторых других элементов. Они являются положительно заряженными частицами с зарядом 2е и массой, примерно в 7300 раз большей массы электрона. Пучки α-частиц обладают высокой монохроматичностью (для данного превращения имеют практически одну и ту же скорость порядка 107 м/с). Резерфорд, исследуя прохождение α-частиц в веществе (через золотую фольгу толщиной примерно 1 мкм), показал, что основная их часть испытывает незначительные отклонения, но некоторые α–частицы, как показано на рис. 11.1 (примерно одна из 20 000), резко отклоняются от первоначального направления (углы отклонения достигали даже 180°). Так как электроны не могут существенно изменить движение столь тяжелых и быстрых частиц, как α-частицы, то Резерфордом был сделан вывод, что значительное отклонение α-частиц обусловлено их взаимодействием с положительным зарядом большой массы. Однако, значительное отклонение испытывают лишь немногие α-частицы; следовательно, лишь некоторые из них проходят вблизи данного положительного заряда. Это, в свою очередь, означает, что положительный заряд атома сосредоточен в объеме, очень малом по сравнению с объемом атома. Эту часть атома Резерфорд назвал атомным ядром.
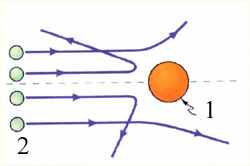
Рис. 11.1. Рассеяние α–частицы в опыте Резерфорда. 1 – атом золота, 2 - α–частицы.
Таким образом, опыты Резерфорда и его сотрудников привели к выводу, что в центре атома находится плотное положительно заряженное ядро, диаметр которого не превышает 10–14–10–15 м. Это ядро занимает только 10–12 часть полного объема атома, но содержит весь положительный заряд и не менее 99,95 % его массы. Веществу, составляющему ядро атома, следовало приписать колоссальную плотность порядка ρ ≈ 1015 г/см3. Заряд ядра должен быть равен суммарному заряду всех электронов, входящих в состав атома. Впоследствии удалось установить, что если заряд электрона принять за единицу, то заряд ядра в точности равен номеру данного элемента в таблице Менделеева.
Ядерная модель атома. Опираясь на классические представления о движении микрочастиц, Резерфорд предложил ядерную (планетарную) модель атома. Согласно этой модели, в центре атома располагается положительно заряженное ядро, в котором сосредоточена почти вся масса атома. Атом в целом нейтрален. Вокруг ядра, подобно планетам, вращаются под действием кулоновских сил со стороны ядра электроны (рис. 11.2). Находиться в состоянии покоя электроны не могут, так как они упали бы на ядро.
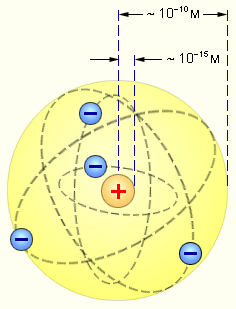
Рис. 11.2 Планетарная модель атома Резерфорда. Показаны круговые орбиты четырёх электронов.
Недостатки модели атома по Резерфорду. Планетарная модель атома, предложенная Резерфордом, явилась крупным шагом в развитии знаний о строении атома. Она была совершенно необходимой для объяснения опытов по рассеянию α-частиц. Однако применение представлений классической электродинамики к ядерной модели атома привело к полному противоречию с экспериментальными фактами. Согласно классической теории, должна иметь место: 1) непрерывная потеря электроном энергии в виде излучения электромагнитных волн и неустойчивость атома, поскольку движущийся с ускорением заряд должен излучать электромагнитные волны, уносящие энергию; 2) существование только непрерывного спектра. Дискретные спектральные линии не должны наблюдаться. То, что этого не происходит в устойчивых состояниях атома, показывает, что внутренние процессы в атоме не подчиняются классическим законам.
11.2. Постулаты Бора
Первая попытка построения неклассической теории атома была предпринята Нильсом Бором (1913 г.). Проанализировав всю совокупность опытных фактов, Бор пришел к выводу, что при описании поведения атомных систем следует отказаться от многих представлений классической физики. Он сформулировал постулаты, которым должна удовлетворять новая теория о строении атомов.
Первый постулат Бора (постулат стационарных состояний) гласит: атомная система может находиться только в особых стационарных или квантовых состояниях, каждому из которых соответствует определенная энергия En. В стационарных состояниях атом не излучает.
Этот постулат находится в явном противоречии с классической механикой, согласно которой энергия движущегося электрона может быть любой. Он находится в противоречии и с электродинамикой, так как допускает возможность ускоренного движения электронов без излучения электромагнитных волн. Согласно первому постулату Бора, атом характеризуется системой энергетических уровней, каждый из которых соответствует определенному стационарному состоянию (рис. 11.3). Механическая энергия электрона, движущегося по замкнутой траектории вокруг положительно заряженного ядра, отрицательна. Поэтому всем стационарным состояниям соответствуют значения энергии En < 0. При En ≥ 0 электрон удаляется от ядра (ионизация). Величина |E1| называется энергией ионизации. Состояние с энергией E1 называется основным состоянием атома.
Второй постулат Бора (правило частот) формулируется следующим образом: при переходе атома из одного стационарного состояния с энергией En в другое стационарное состояние с энергией Em излучается или поглощается квант, энергия которого равна разности энергий стационарных состояний:
| (11.1) |
где h – постоянная Планка. Отсюда можно выразить частоту излучения:
 | (11.2) |
Второй постулат Бора также противоречит электродинамике Максвелла, так как частота излучения определяется только изменением энергии атома и никак не зависит от характера движения электрона (Рис.11.3).
Правило квантования орбит Бора утверждает: в стационарном состоянии атома электрон, двигаясь по круговой орбите, должен иметь квантованные значения момента импульса, удовлетворяющие условию
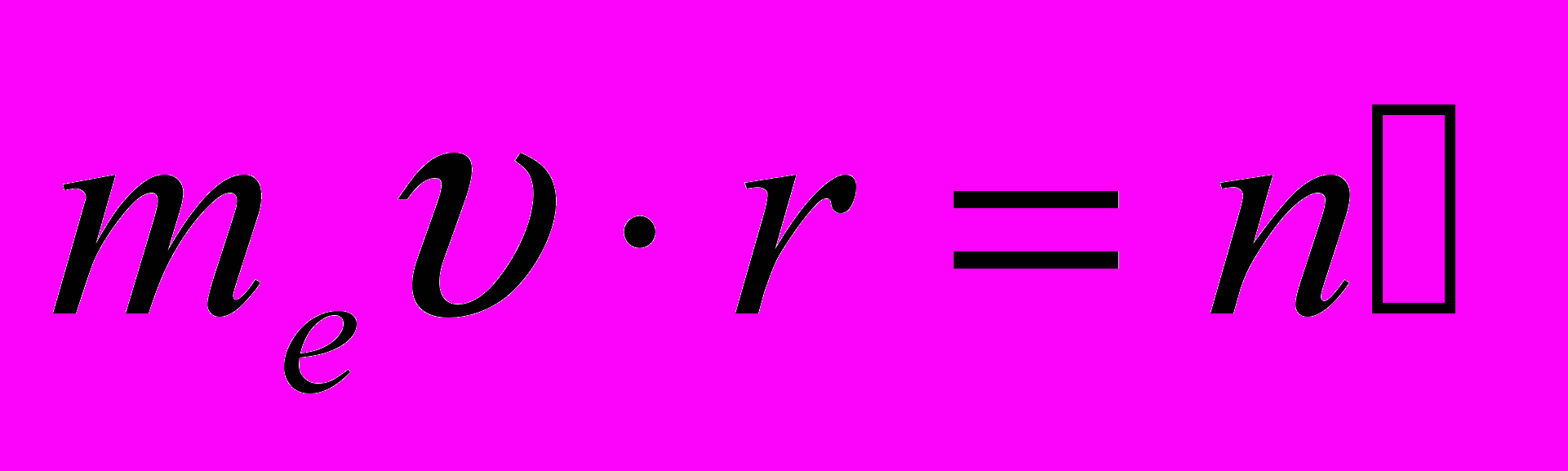 (n = 1, 2, 3, …). (n = 1, 2, 3, …). | (11.3) |
Теория Бора не отвергла полностью законы классической физики при описании поведения атомных систем. В ней сохранились представления об орбитальном движении электронов в кулоновском поле ядра (Рис. 11.4.1 и 11.4.2). Классическая ядерная модель атома Резерфорда была дополнена в теории Бора идеей о квантовании электронных орбит. Поэтому теорию Бора иногда называют полуклассической.
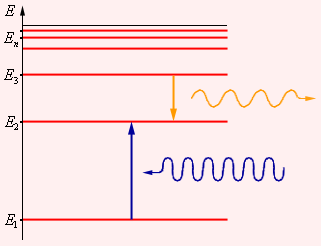 |
Рис. 11.3. Энергетические уровни атома и условное изображение процессов поглощения и испускания фотонов.
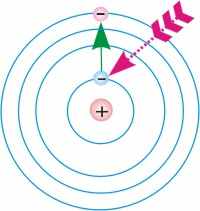 | 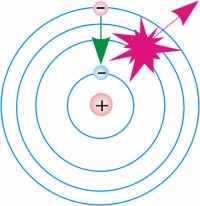 |
| Рис. 11.4.1. Переход электрона из основного стационарного состояния в возбужденное с поглощением фотонов. | Рис. 11.4.2. Переход электрона из возбуждённого состояния в основное состояние с испусканием фотонов. |
11.3. Экспериментальное подтверждение постулатов Бора
Опыты Д.Франка и Г.Герца. Постулаты Бора нашли своё экспериментальное подтверждение в опытах Д.Франка и Г.Герца (1913), в которых изучались столкновения электронов с атомами газов. Принципиальная схема их установки приведена на рис.11.5. Вакуумная трубка, заполненная парами ртути при давлении около 15 Па, содержала катод (К), две сетки (С1 и С2) и анод (А). Электроны, испускаемые катодом, ускорялись разностью потенциалов между катодом и сеткой С1. Между сеткой С2 и анодом приложен задерживающий потенциал 0,5 В. Электроны, ускоренные в области 1 попадают в область 2 между сетками, где испытывают соударения с атомами паров ртути. Электроны, которые после соударений имеют достаточную энергию для преодоления задерживающего потенциала в области 3, достигают анода. При неупругих соударениях электронов с атомами ртути последние могут возбуждаться. Согласно боровской теории, каждый из атомов ртути может получить лишь вполне определенную энергию, переходя при этом в одно из возбужденных состояний. Поэтому если в атомах действительно существуют стационарные состояния, то электроны, сталкиваясь с атомами ртути, должны терять энергию дискретно, определенными порциями, равными разности энергий соответствующих стационарных состояний атома.
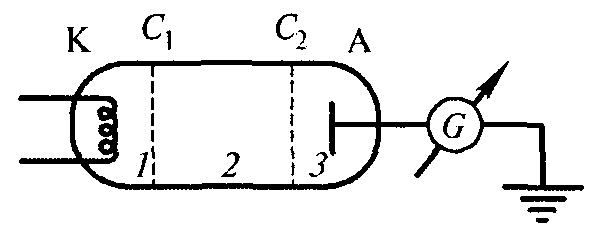
Рис.11.5. Принципиальная схема установки в опытах Д.Франка и Г.Герца.
Из опыта следует (рис. 11.6), что при увеличении ускоряющего потенциала вплоть до 4.86 В анодный ток возрастает монотонно, его значение проходит через максимум (4,86 В), затем резко уменьшается и возрастает вновь. Дальнейшие максимумы наблюдаются при 2 · 4,86 В и 3 · 4.86 В.
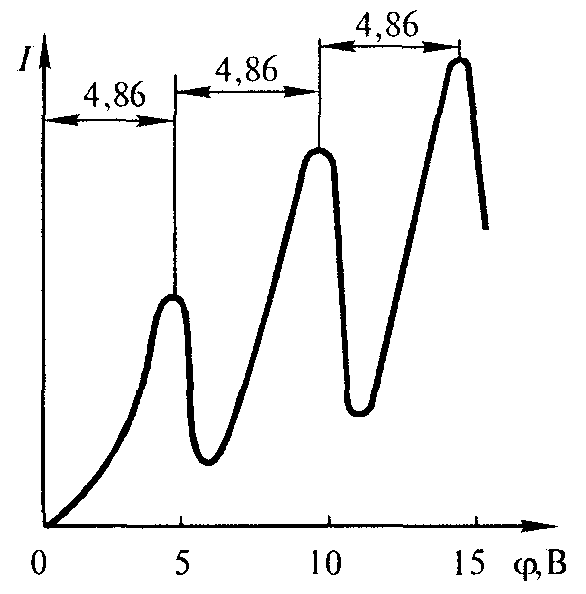
Рис. 11.6. Зависимость анодного тока I от ускоряющего потенциала φ в опытах Д.Франка и Г.Герца.
Ближайшим к основному, невозбужденному, состоянию атома ртути является возбужденное состояние, отстоящее от основного по шкале энергий на 4.86 эВ. Пока разность потенциалов между катодом и сеткой меньше 4,86 В, электроны, встречая на своем пути атомы ртути, испытывают с ними только упругие соударения. При еφ = 4,86 эВ энергия электрона становится достаточной, чтобы вызвать неупругий удар, при котором электрон отдает атому ртути всю кинетическую энергию, возбуждая переход одного из электронов атома из нормального энергетического состояния на возбужденный энергетический уровень. Электроны, потерявшие свою кинетическую энергию, уже не смогут преодолеть тормозящего поля и достигнуть анода. Этим и объясняется первое резкое падение анодного тока при еφ = 4,86 эВ. При значениях энергии, кратных 4,86 эВ, электроны могут испытать с атомами ртути 2, 3, ... неупругих соударения, потеряв при этом полностью свою энергию, и не достигнув анода, т. е. должно наблюдаться резкое падение анодного тока. Это действительно наблюдается на опыте (рис. 11.6). Таким образом, опыты Франка и Герца показали, что электроны при столкновении с атомами ртути передают атомам только определенные порции энергии, причем 4,86 эВ - наименьшая возможная порция энергии (наименьший квант энергии), которая может быть поглощена атомом ртути в основном энергетическом состоянии. Следовательно, идея Бора о существовании в атомах стационарных состояний выдержала экспериментальную проверку.

Атомы ртути, получившие при соударении с электронами энергию ∆E, переходят в возбужденное состояние и должны возвратиться в основное, излучая при этом, согласно второму постулату Бора (см. (11.2)), световой квант с частотой
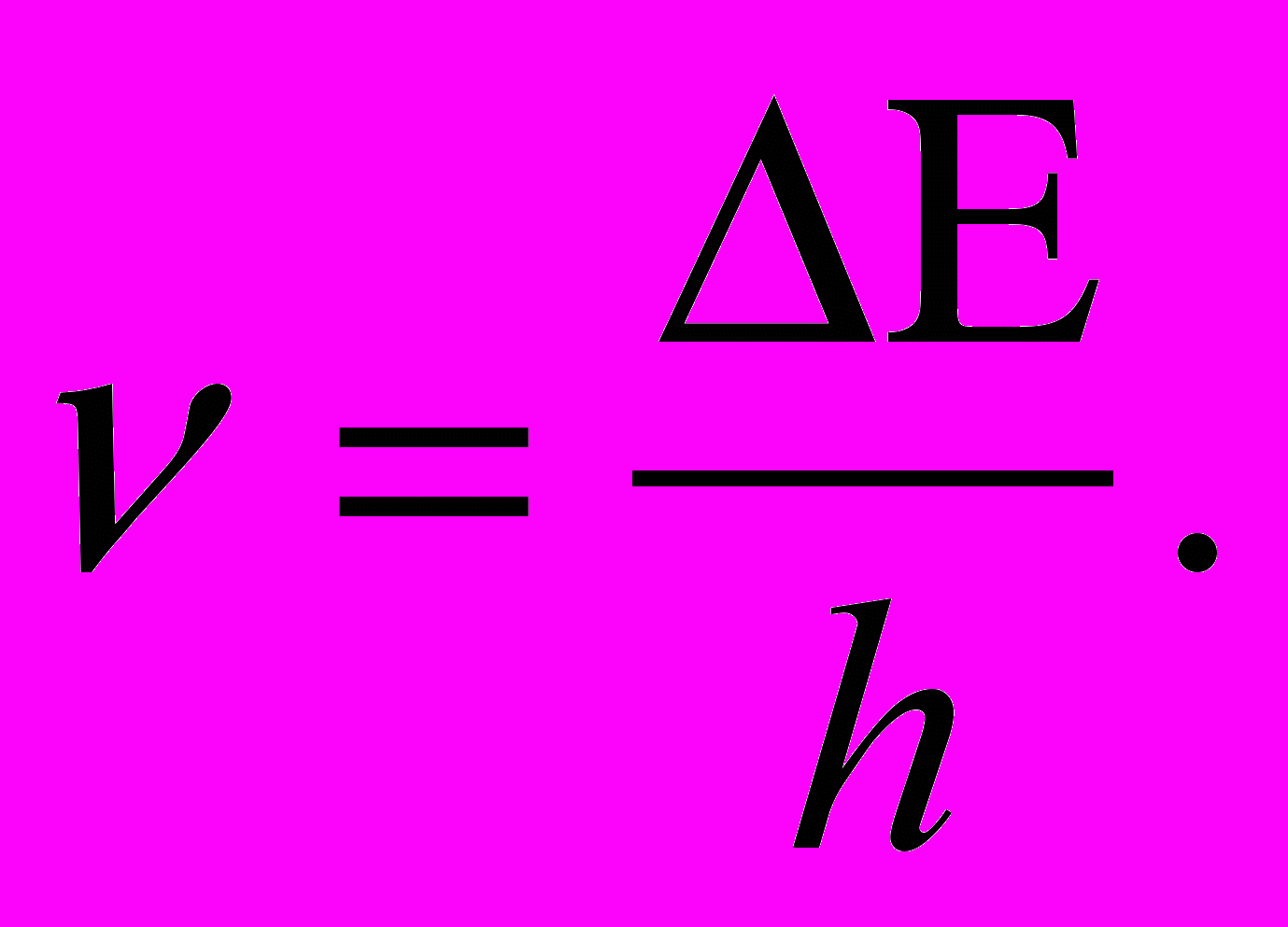 По известному ∆E = 4,86 эВ можно вычислить длину волны излучения:
По известному ∆E = 4,86 эВ можно вычислить длину волны излучения: 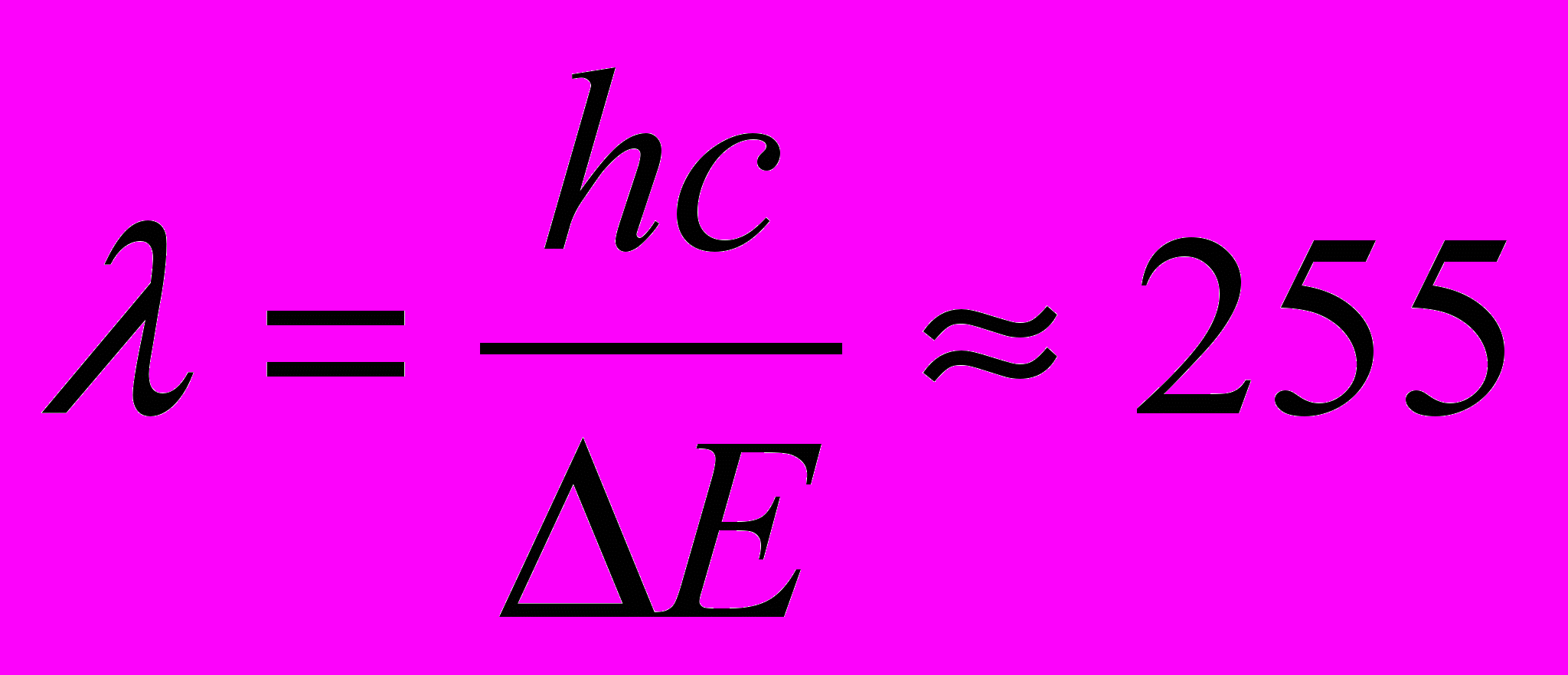 нм. Таким образом, если теория верна, то атомы ртути, бомбардируемые электронами с энергией 4,86 эВ, должны являться источником ультрафиолетового излучения с
нм. Таким образом, если теория верна, то атомы ртути, бомбардируемые электронами с энергией 4,86 эВ, должны являться источником ультрафиолетового излучения с 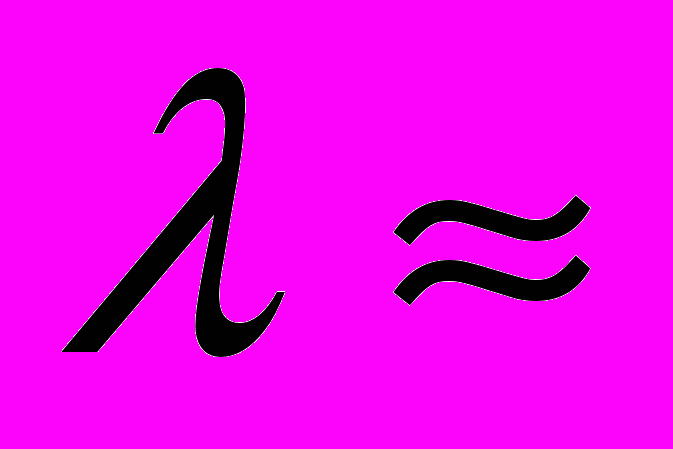 255 нм. Эта величина хорошо согласуется с экспериментальным результатом
255 нм. Эта величина хорошо согласуется с экспериментальным результатом 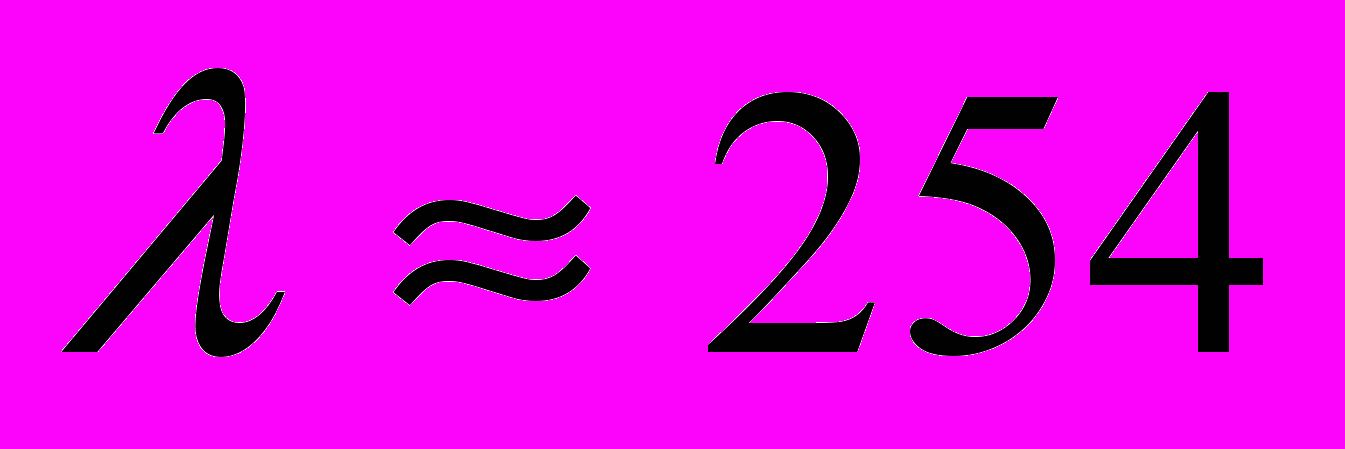 нм. Таким образом, опыты Франка и Герца подтвердили не только первый, но и второй постулат Бора.
нм. Таким образом, опыты Франка и Герца подтвердили не только первый, но и второй постулат Бора. 11.4. Теория атома водорода по Бору
Постулаты, выдвинутые Бором, позволили рассчитать спектр атома водорода и водородоподобных систем - систем, состоящих из ядра с зарядом Ze и одного электрона (например, ионы Не+, Li2+), а также теоретически вычислить постоянную Ридберга.

Следуя Бору, рассмотрим движение электрона в водородоподобной системе, ограничиваясь круговыми стационарными орбитами. Второй закон Ньютона для электрона с массой me, движущегося со скоростью
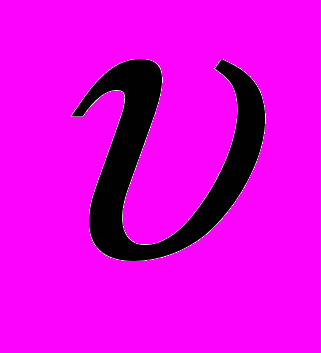 по окружности радиуса r под действием кулоновской силы, имеет вид
по окружности радиуса r под действием кулоновской силы, имеет вид 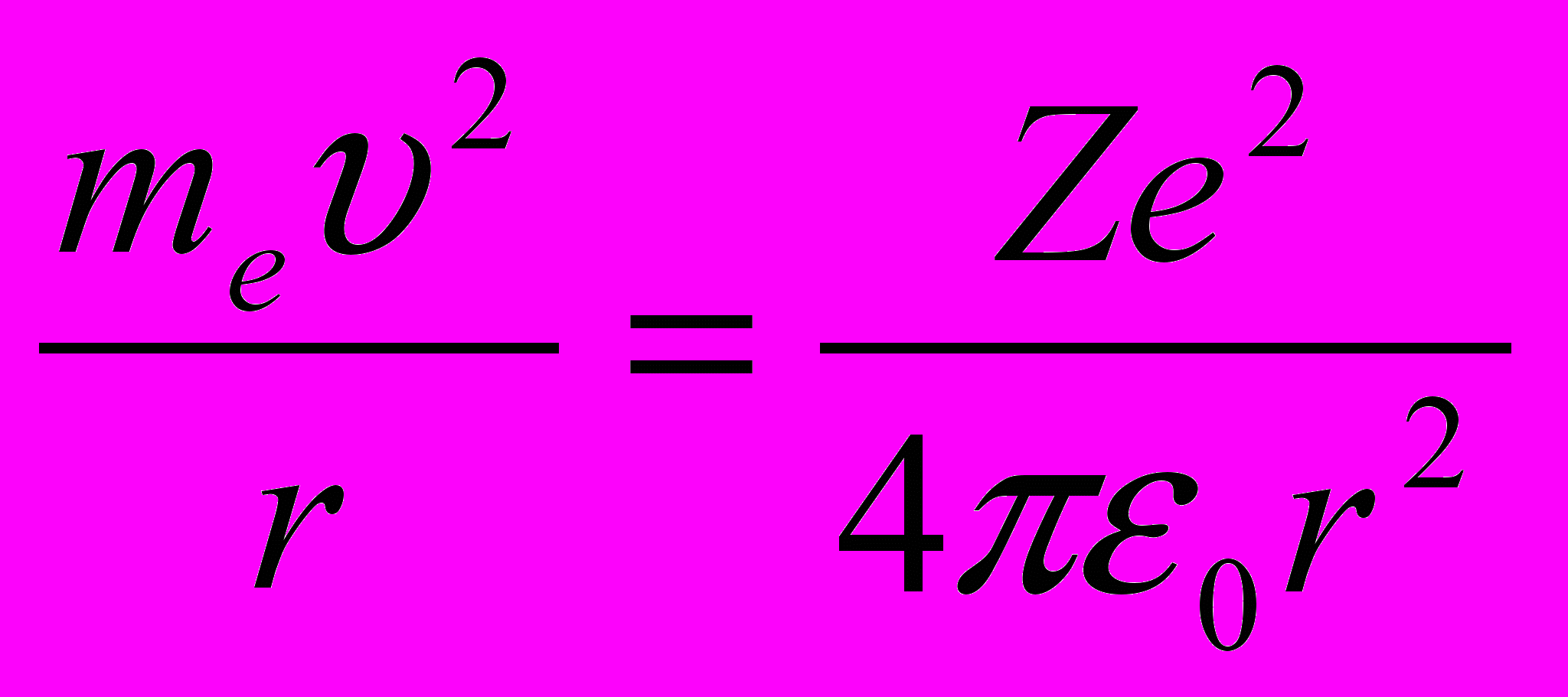 | (11.4) |
Решая совместно уравнение (11.4), и уравнение (11.3), получим выражение для радиуса n-й стационарной орбиты:
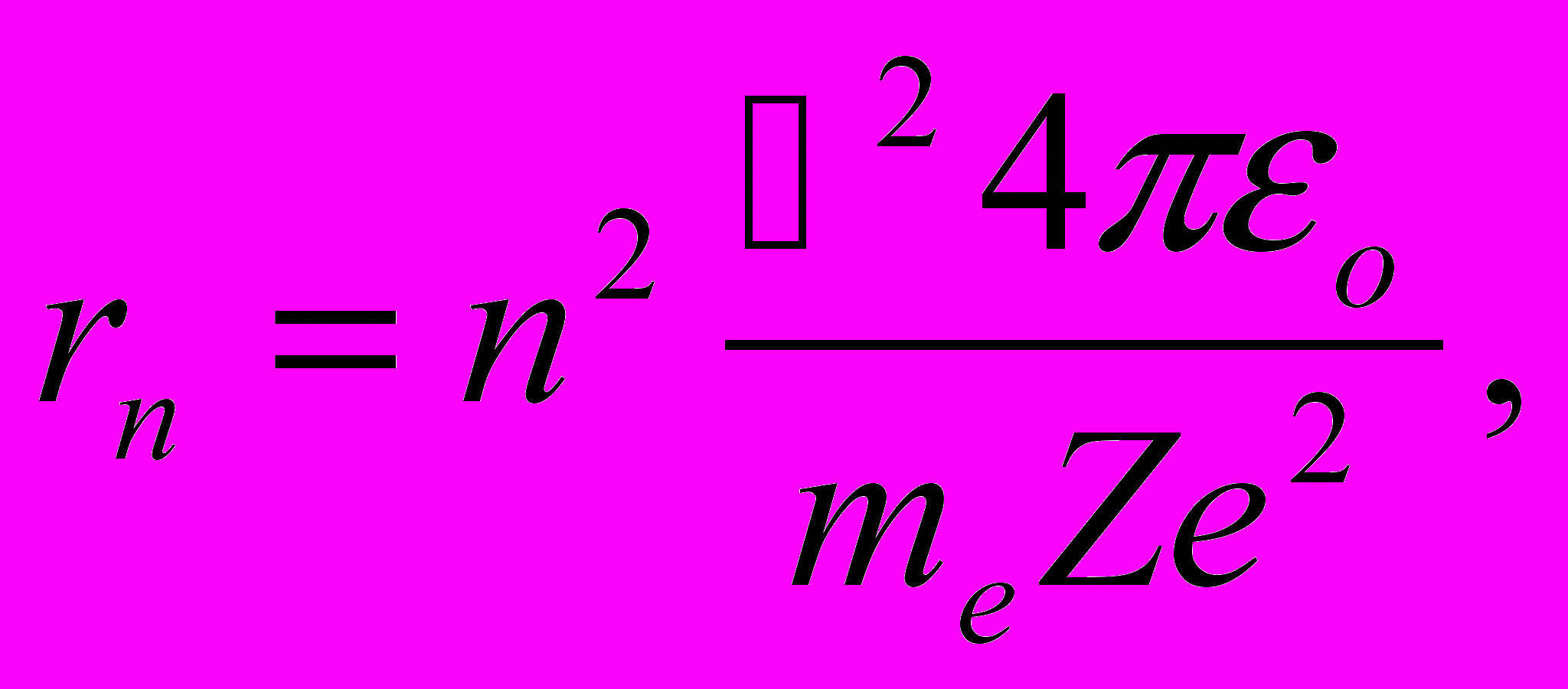 (n = 1, 2, 3, …). (n = 1, 2, 3, …). | (11.5) |
Из выражения (11.5) следует, что радиусы орбит растут пропорционально квадратам целых чисел. Для атома водорода (Z = 1) радиус первой орбиты электрона при n = 1, называемый первым боровским радиусом (rB), равен
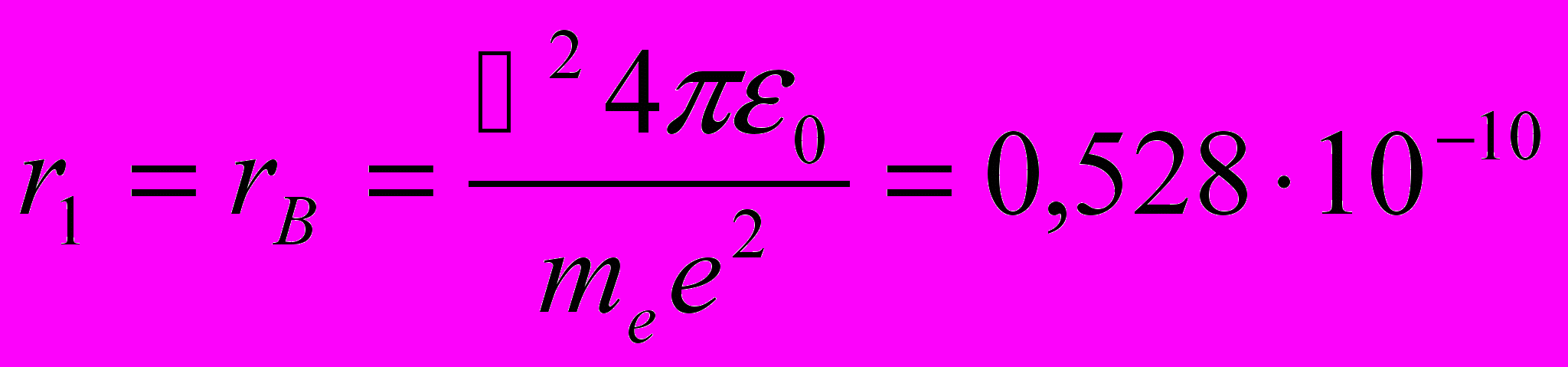 | (11.6) |
Полная энергия электрона в водородоподобной системе складывается из его кинетической энергии
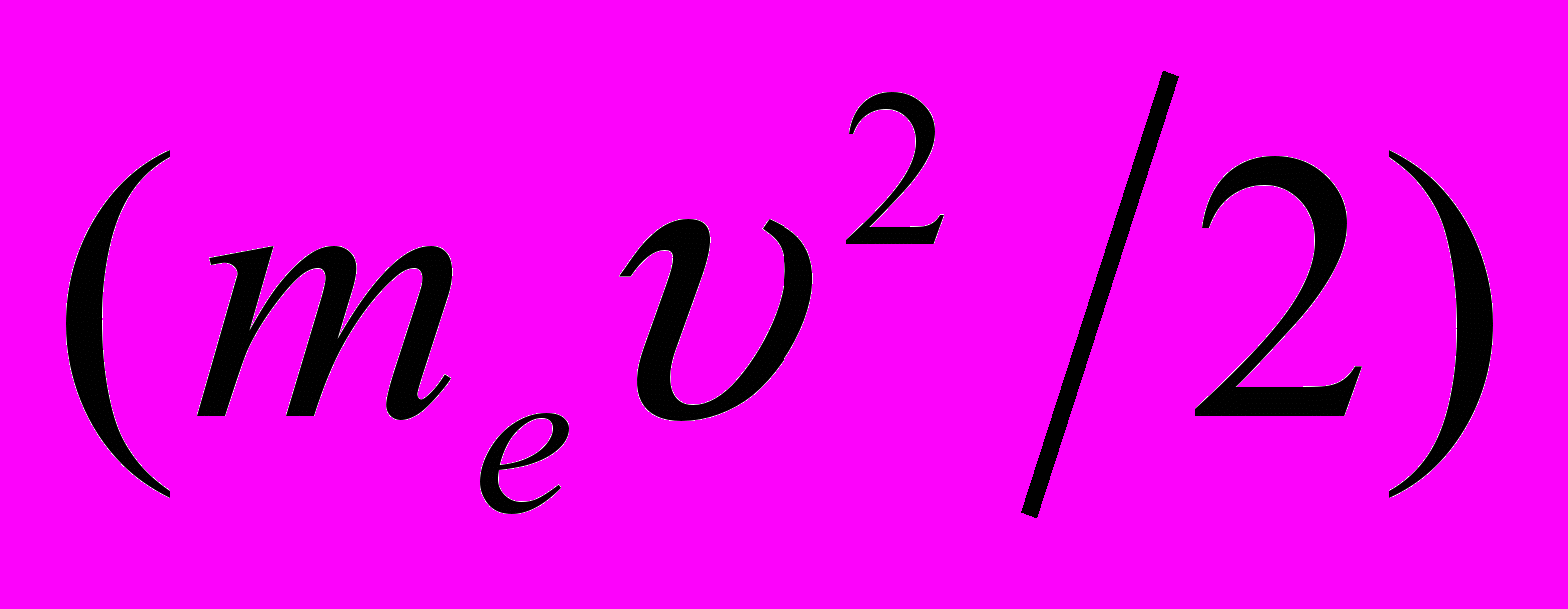 и потенциальной энергии в электростатическом поле ядра
и потенциальной энергии в электростатическом поле ядра 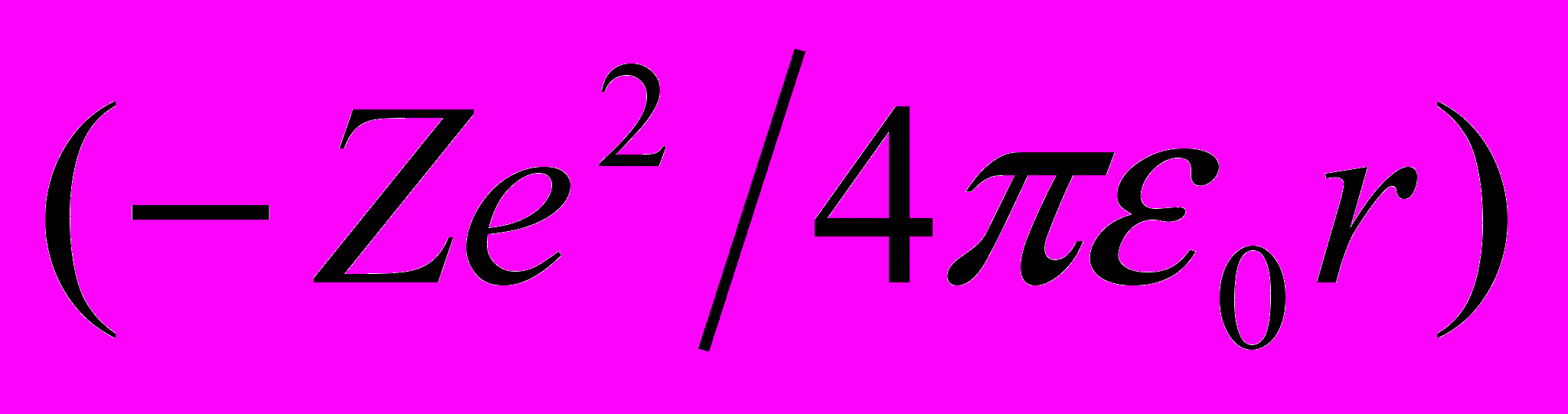 :
: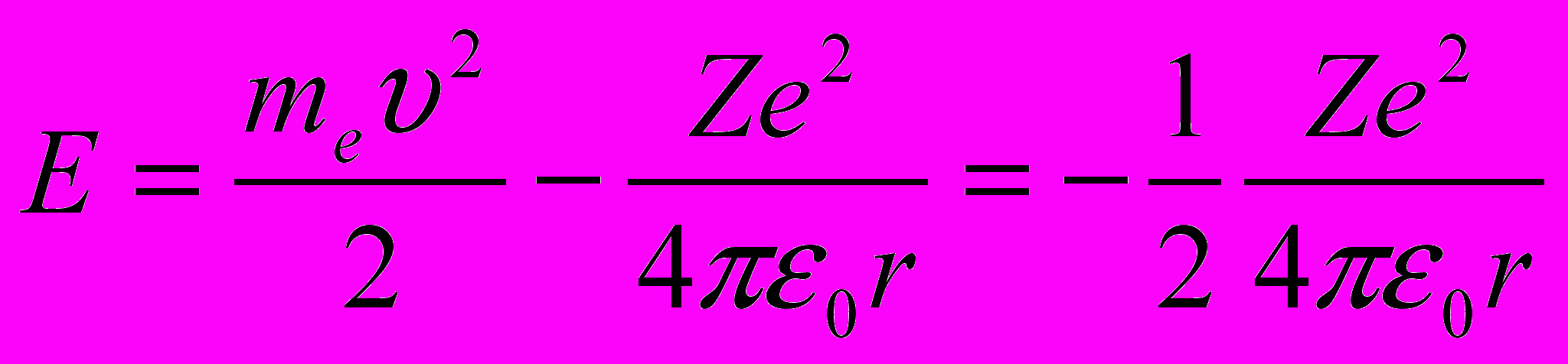
[учли, что
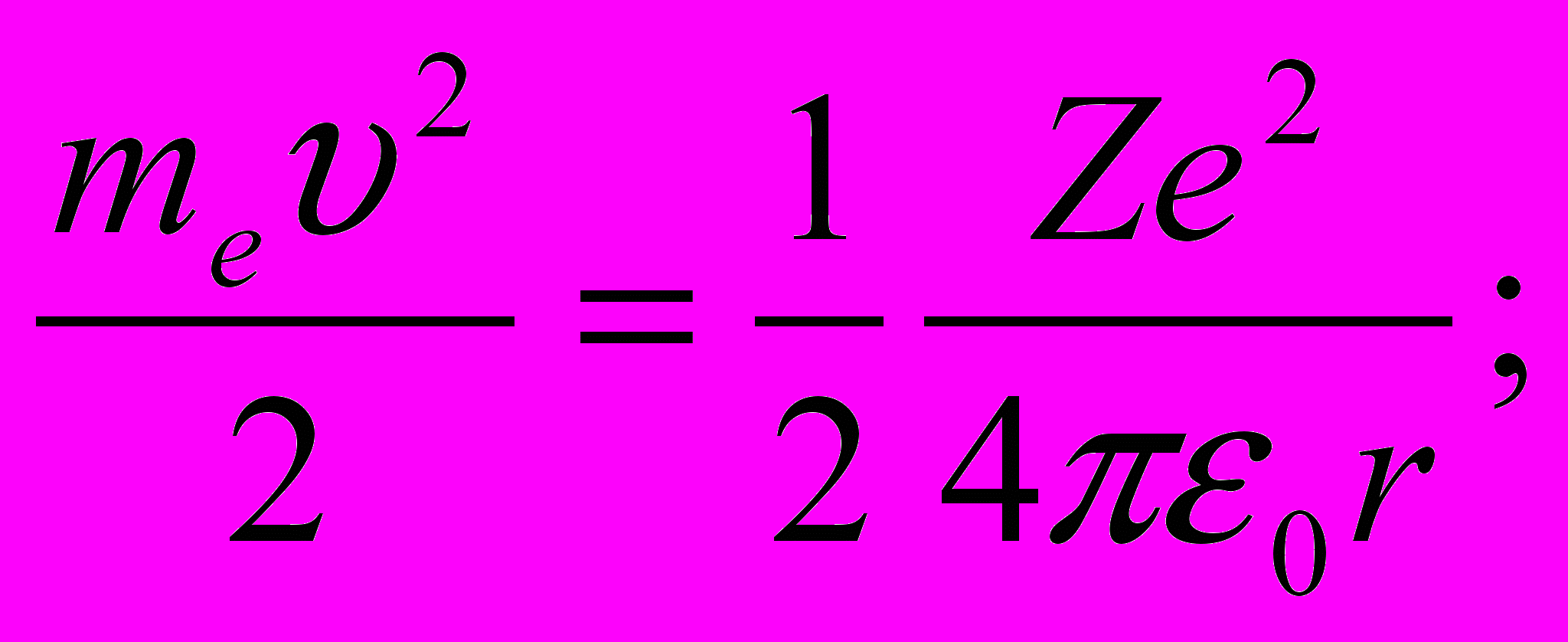 см.(11.4)]. Учитывая квантованные для радиуса n-й стационарной орбиты значения (11.5), получим, что энергия электрона может принимать только следующие дозволенные дискретные значения:
см.(11.4)]. Учитывая квантованные для радиуса n-й стационарной орбиты значения (11.5), получим, что энергия электрона может принимать только следующие дозволенные дискретные значения: 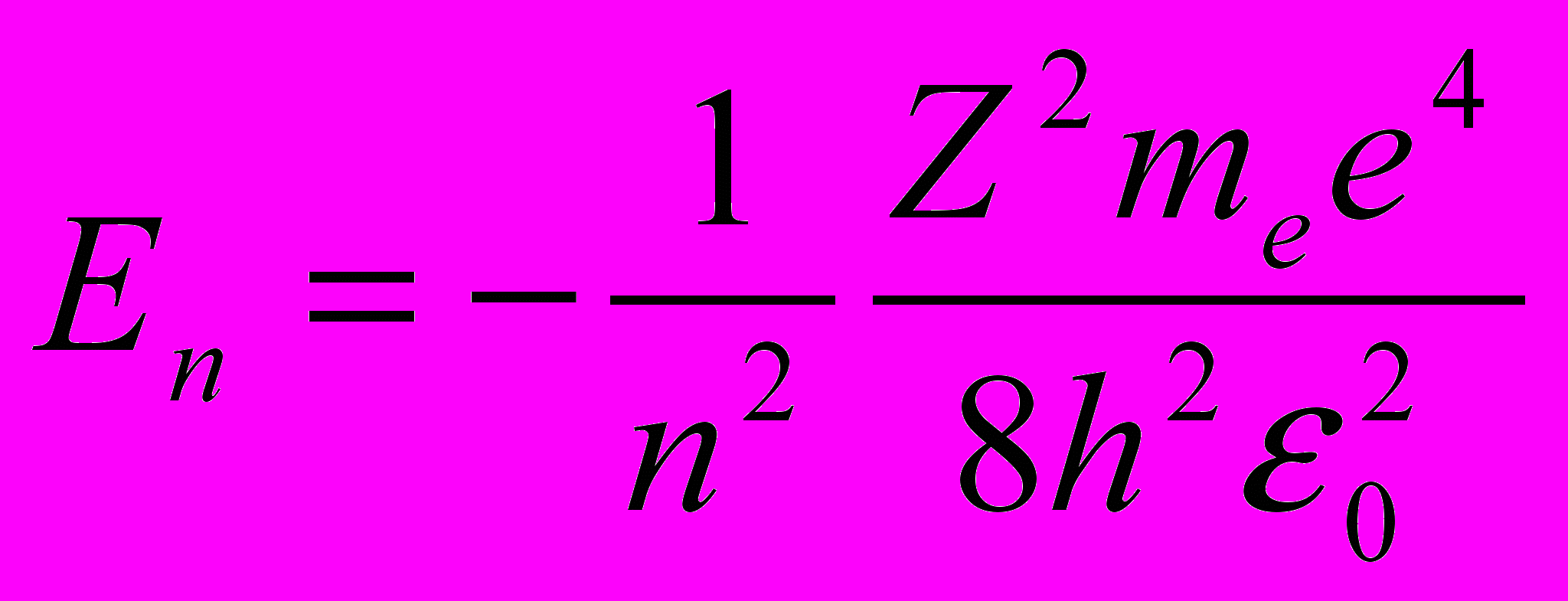 (n = 1, 2, 3, …), (n = 1, 2, 3, …), | (11.7) |
где знак « - » означает, что электрон находится в связанном состоянии.
Из формулы (11.7) следует, что энергетические состояния атома образуют последовательность энергетических уровней, изменяющихся в зависимости от значения n. Целое число n в выражении (11.7), определяющее энергетические уровни атома, называется главным квантовым числом. Энергетическое состояние с n = 1 является основным (нормальным) состоянием; состояния с n > 1 являются возбужденными. Энергетический уровень, соответствующий основному состоянию атома, называется основным (нормальным) уровнем; вес остальные уровни являются возбужденными.
Придавая n различные целочисленные значения, получим для атома водорода (Z = 1), согласно формуле (11.7) возможные уровни энергии, схематически представленные на рис. 11.7 и 11.8. Рис. 11.7 иллюстрирует образование спектральных серий в излучении атома водорода при переходе электрона с высоких стационарных орбит на более низкие. На рис. 11.8 изображена диаграмма энергетических уровней атома водорода и указаны переходы, соответствующие различным спектральным сериям. Энергия атома водорода с увеличением n возрастает и энергетические уровни сближаются к границе, соответствующей значению n = ∞. Атом водорода обладает, таким образом, минимальной энергией (Е1 = = - 13,6 эВ) при п = 1 и максимальной (Е∞ = 0) при n = ∞. Следовательно, значение Е∞ = 0 соответствует ионизации атома (отрыву от него электрона). Согласно второму постулату Бора (см. (11.1)), при переходе атома водорода (Z = 1) из стационарного состояния n в стационарное состояние т с меньшей энергией испускается квант
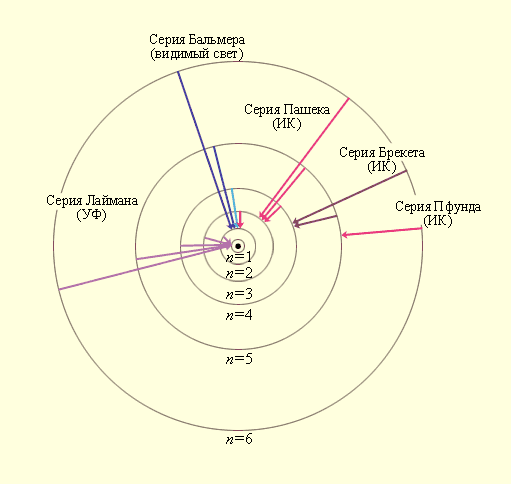
Рис. 11.7. Стационарные орбиты атома водорода и образование спектральных серий.
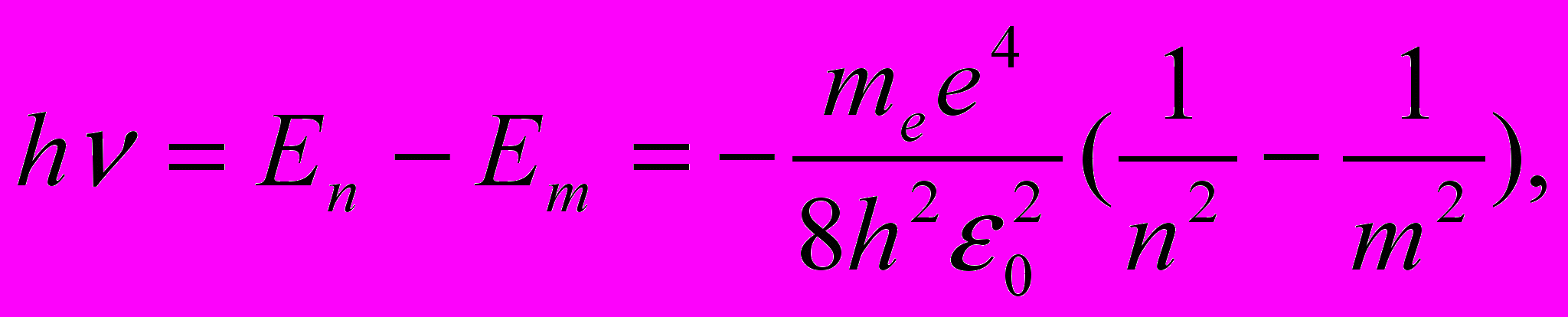 | (11.8) |
Откуда частота излучения
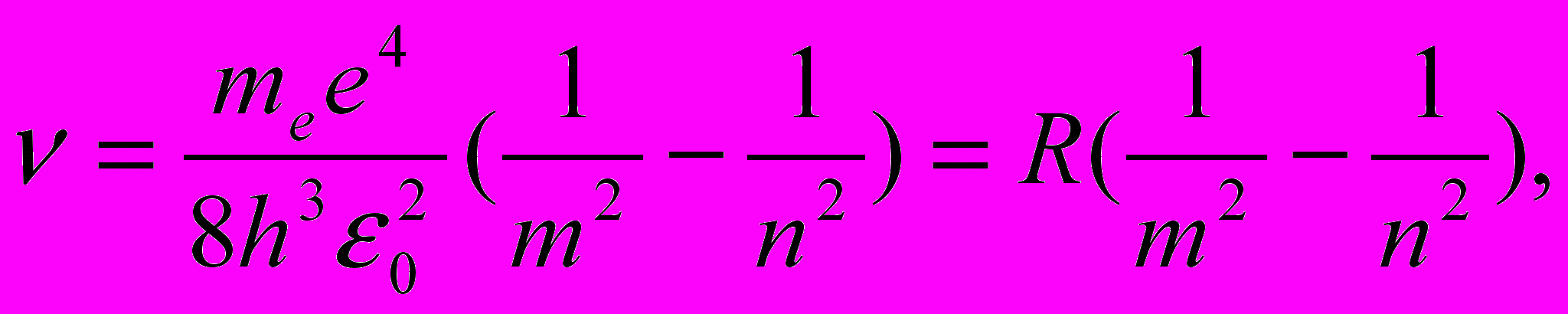 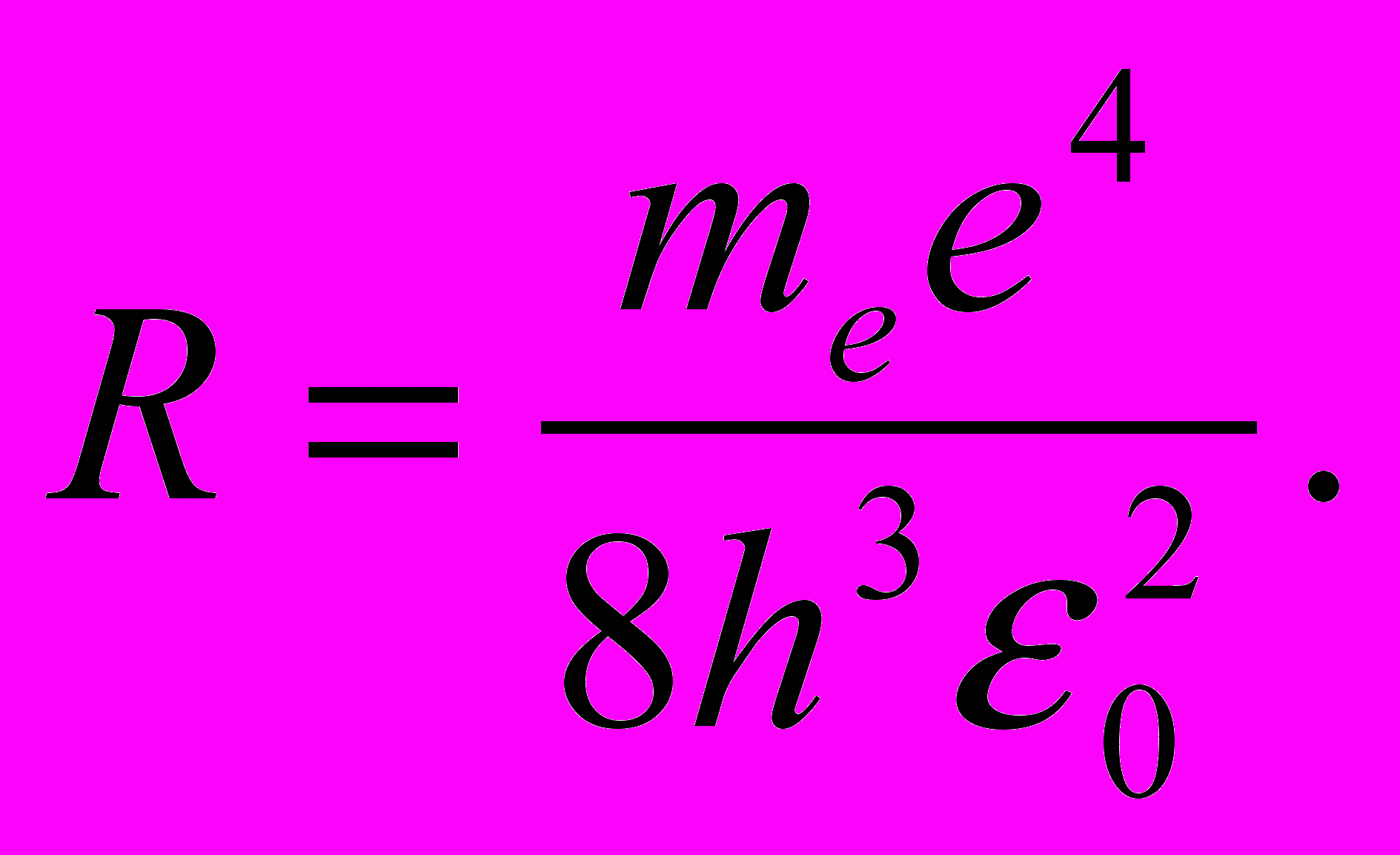 | (11.9) |
Воспользовавшись при вычислении R современными значениями универсальных постоянных, получим величину, совпадающую с экспериментальным значением постоянной Ридберга в эмпирических формулах для атома водорода.
Прекрасное согласие боровской теории атома водорода с экспериментом служило веским аргументом в пользу ее справедливости. Стало ясно, что атомы – это квантовые системы. Энергетические уровни стационарных состояний атомов дискретны. Представление о дискретных состояниях противоречит классической физике. Поэтому возник вопрос, не опровергает ли квантовая теория законы классической физики. Квантовая физика не отменила фундаментальных классических законов сохранения энергии, импульса, электрического разряда и т. д. Согласно сформулированному Н. Бором принципу соответствия, квантовая физика включает в себя законы классической физики, и при определенных условиях можно обнаружить плавный переход от квантовых представлений к классическим. Это можно видеть на примере энергетического спектра атома водорода (рис. 11.8). При больших квантовых числах n >> 1 дискретные уровни постепенно сближаются, и возникает плавный переход в область непрерывного спектра, характерного для классической физики.
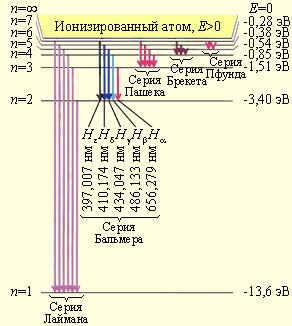
Рис. 11.8. Диаграмма энергетических уровней атома водорода. Показаны переходы, соответствующие различным спектральным сериям. Для первых пяти линий серии Бальмера в видимой части спектра указаны длины волн.
Недостатки теории Бора. Попытки применить теорию Бора к более сложным атомам (даже для атома гелия) не увенчались успехом. Эта теория обладает внутренними противоречиями: с одной стороны, применяет законы классической физики, а с другой - основывается на квантовых постулатах. Бор не смог дать физическую интерпретацию правилу квантования. Это было сделано де Бройлем (1923) на основе представлений о волновых свойствах частиц.
11.5. Гипотеза де Бройля
Гипотеза де Бройля о волновых свойствах вещества. Де Бройль, развивая представления о двойственной корпускулярно-волновой природе света, выдвинул гипотезу об универсальности корпускулярно-волнового дуализма. Он предположил, что не только фотоны, но и электроны и любые другие частицы материи наряду с корпускулярными обладают также волновыми свойствами. Итак, согласно де Бройлю, с каждым микрообъектом связываются, с одной стороны, корпускулярные характеристики - энергия Е и импульс р, а с другой - волновые характеристики - частота
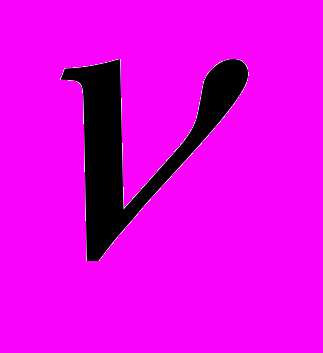 и длина волны
и длина волны 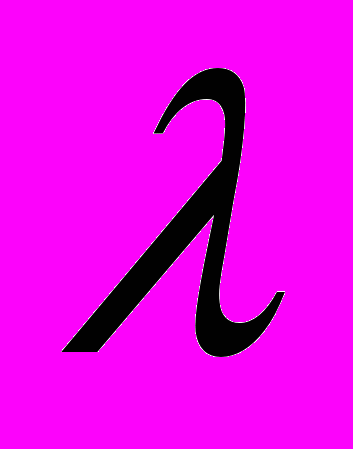 . Количественные соотношения, связывающие корпускулярные и волновые свойства частиц, такие же, как для фотонов:
. Количественные соотношения, связывающие корпускулярные и волновые свойства частиц, такие же, как для фотонов: 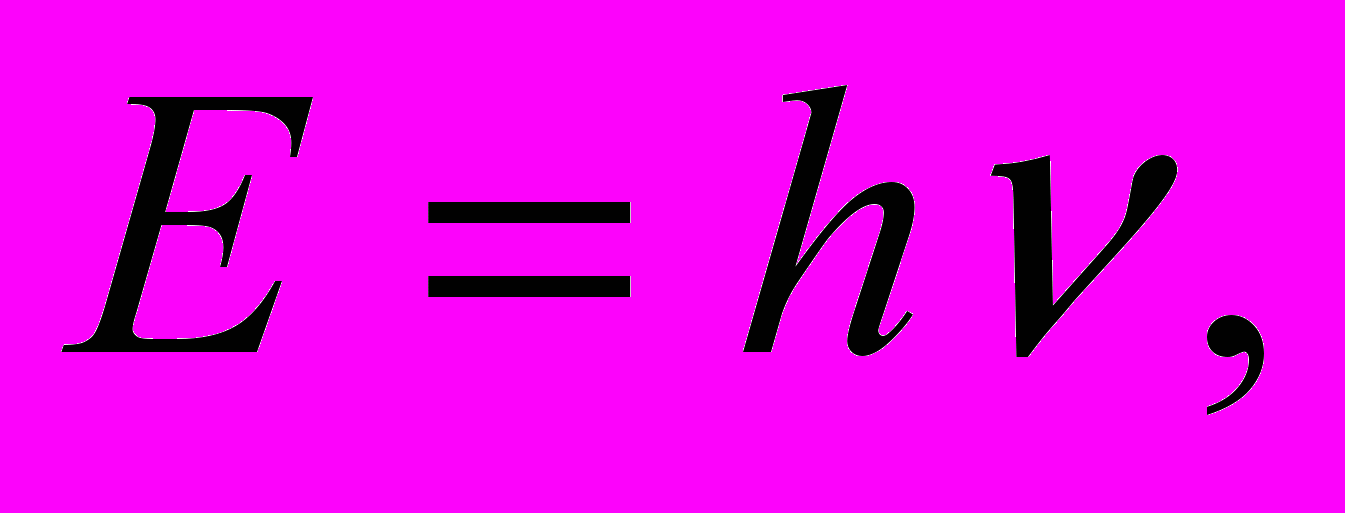 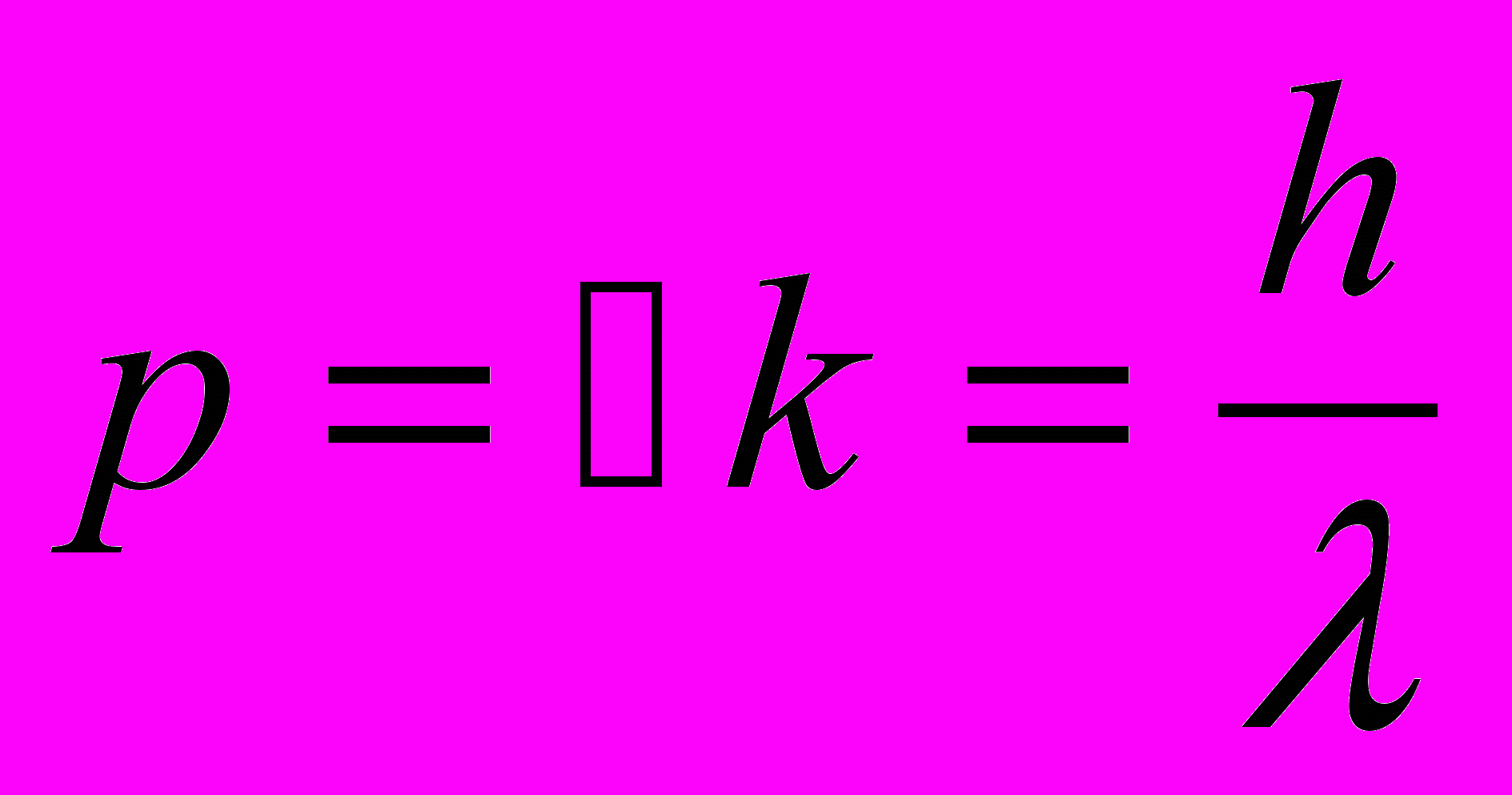 . . | (11.10) |
Таким образом, любой частице, обладающей импульсом, сопоставляется волновой процесс, длина волны которого определяется по формуле де Бройля:
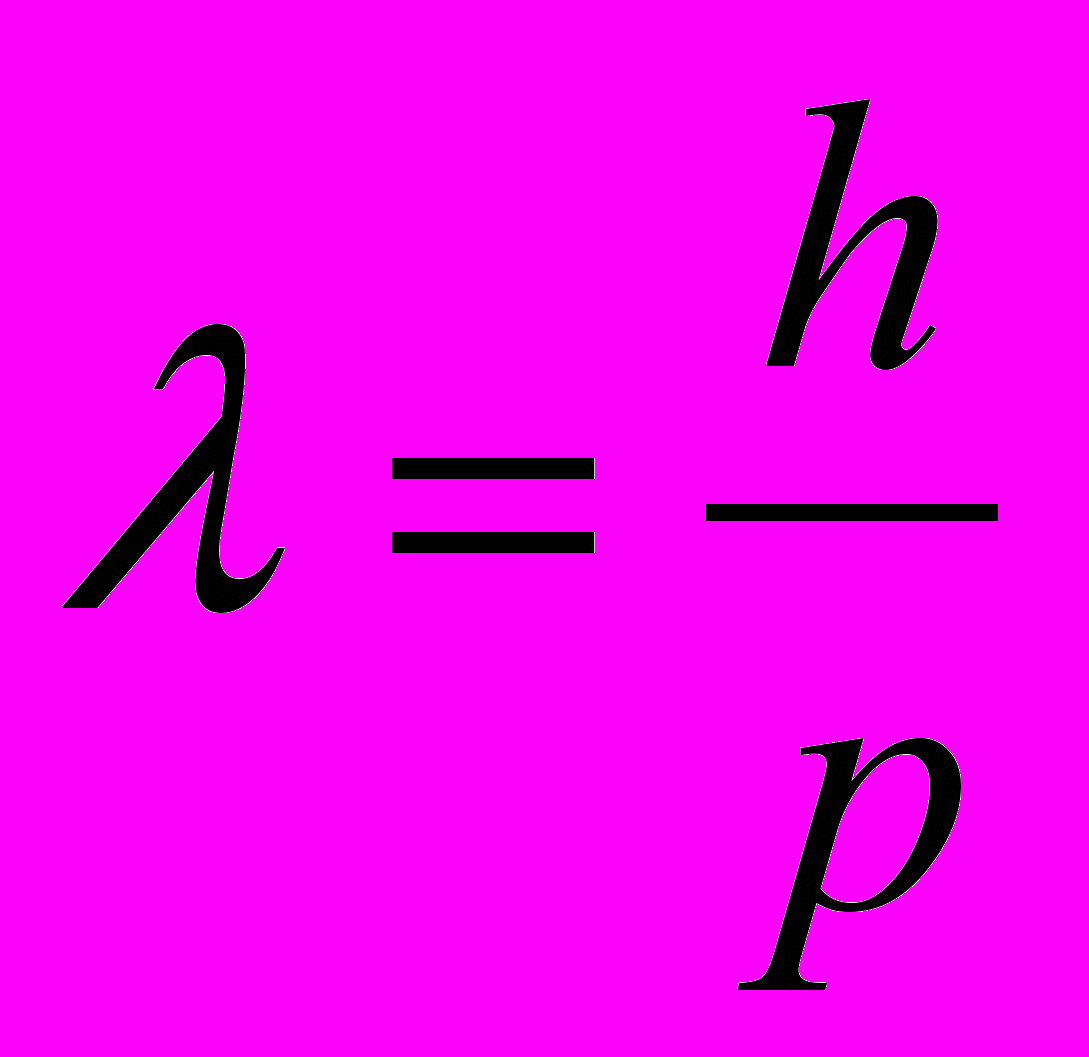 . . | (11.11) |
Де Бройль предложил, что каждая орбита в атоме водорода соответствует волне, распространяющейся по окружности около ядра атома. Стационарная орбита возникает в том случае, когда волна непрерывно повторяет себя после каждого оборота вокруг ядра. Другими словами, стационарная орбита соответствует круговой стоячей волне де Бройля на длине орбиты (рис. 11.9). Это явление очень похоже на стационарную картину стоячих волн в струне с закрепленными концами. В стационарном квантовом состоянии атома водорода на длине орбиты должно укладываться по идее де Бройля целое число длин волн λ, то есть
| nλn = 2πrn | (11.10) |
Подставляя в это соотношение длину волны де Бройля λ = h / p, где p = meυ – импульс электрона, получим:
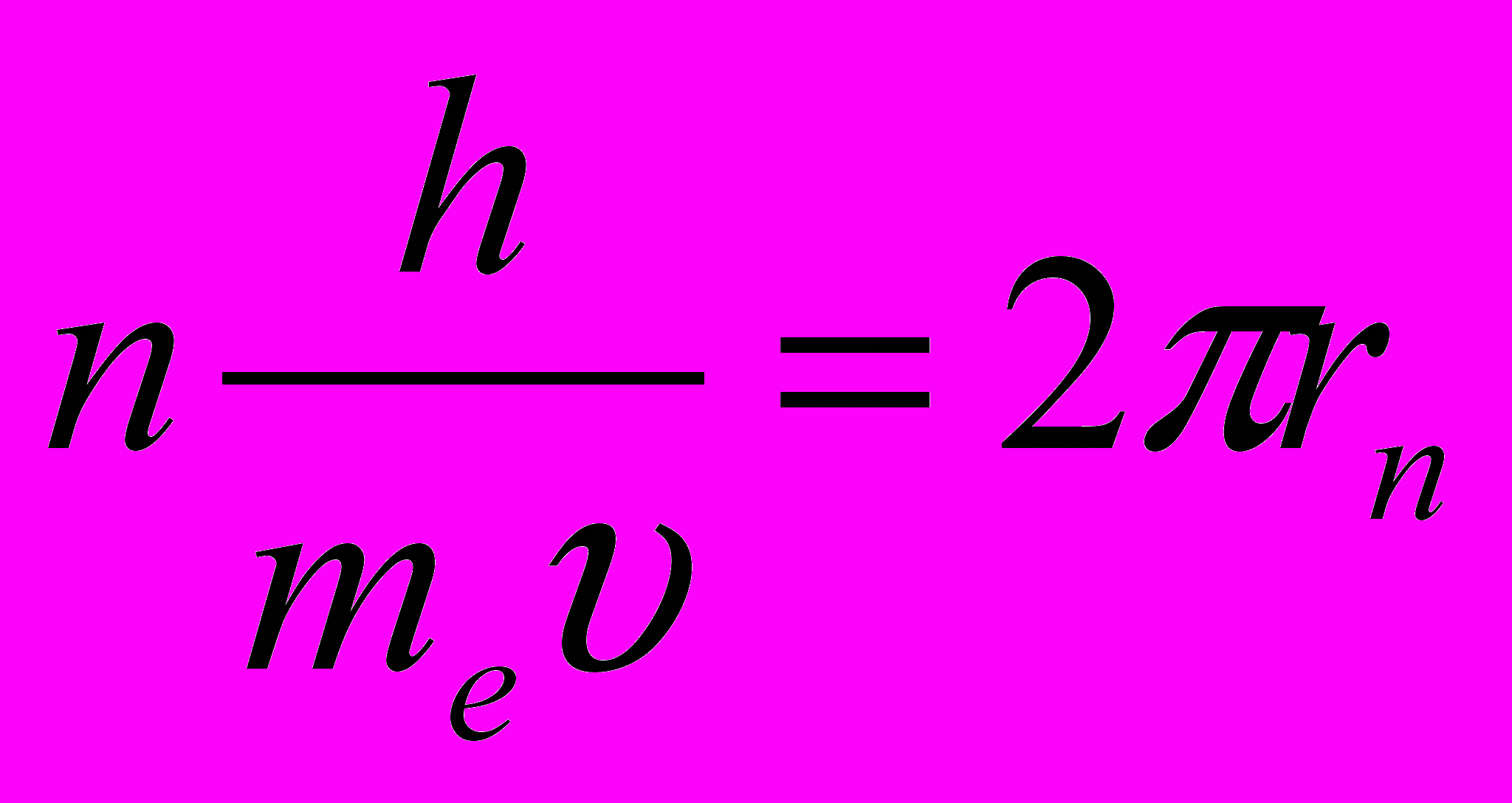 или или 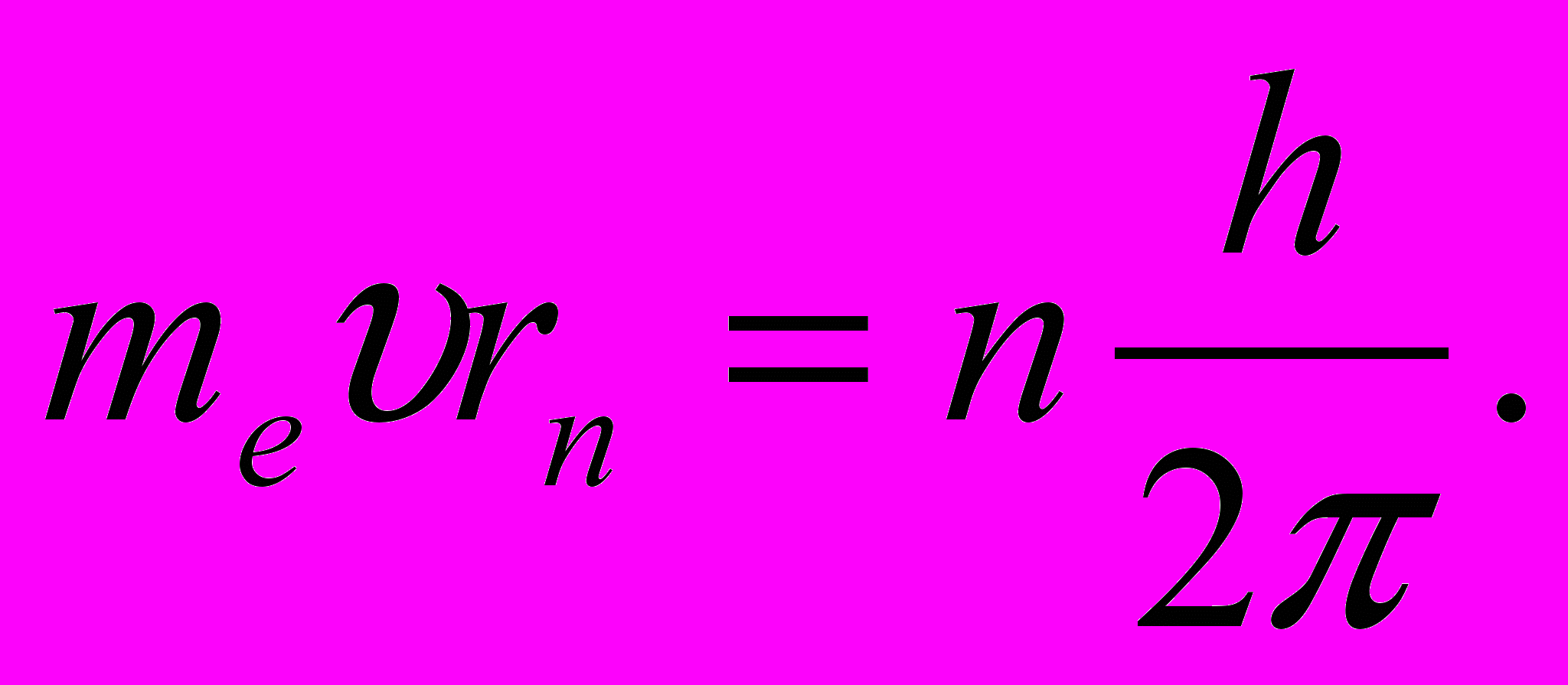 | (11.11) |
Таким образом, боровское правило квантования (11.3) связано с волновыми свойствами электронов.
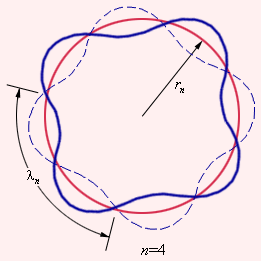
Рис.11.9. Иллюстрация идеи де Бройля возникновения стоячих волн на стационарной орбите для случая n = 4.
Экспериментальное подтверждение гипотезы де Бройля. Вскоре гипотеза де Бройля была подтверждена экспериментально. В 1927 г. К. Дэвиссон и Л. Джермер обнаружили, что пучок электронов, рассеивающийся от естественной дифракционной решетки - кристалла никеля,- дает отчетливую дифракционную картину. Дифракционные максимумы соответствовали формуле Вульфа – Брэггов, а брэгговская длина волны оказалась в точности равной длине волны, вычисленной по формуле (11.11).
В дальнейшем формула де Бройля была подтверждена опытами П.С. Тартаковского и Г. Томсона, наблюдавших дифракционную картину при прохождении пучка быстрых электронов (энергия == 50 кэВ) через металлическую фольгу (толщиной ≈ 1 мкм).
Впоследствии дифракционные явления обнаружили также для нейтронов, протонов, атомных и молекулярных пучков. Это окончательно послужило доказательством наличия волновых свойств микрочастиц и позволило описывать движение микрочастиц в виде волнового процесса, характеризующегося определенной длиной волны, рассчитываемой по формуле де Бройля (11.11). Открытие волновых свойств микрочастиц привело к появлению и развитию новых методов исследования структуры веществ, таких, как электронография и нейтронография, а также к возникновению новой отрасли науки - электронной оптики.
Экспериментальное доказательство наличия волновых свойств микрочастиц привело к выводу о том, что перед нами универсальное явление, общее свойство материи. Но тогда волновые свойства должны быть присущи и макроскопическим телам. Почему же они не обнаружены экспериментально? Например, частице массой 1 г, движущейся со скоростью 1 м/с соответствует волна де Бройля с λ = 6,62 · 10-31 м. Такая длина волны лежит за пределами доступной наблюдению области. Поэтому считается, что макроскопические тела проявляют только одну сторону своих свойств - корпускулярную и не проявляют волновую.
