Главная
/ Ответы на экзамены / химия - 9 класс
| Классификация химических реакций.
тов реакции; б) выделение или поглощение теплоты; в) изменение степени окисления химических элементов; г) наличие или отсутствие катализатора; д) обратимость реакций. а) По числу и составу исходных веществ и продуктов реакции химические реакции можно разделить на следующие типы: разложение; соединение; обмен; замещение Разложение — это реакция, в результате которой из одного вещества получается несколько. Разложению могут быть подвергнуты некоторые соли, кислоты, оксиды и основания (прежде всего нерастворимые): 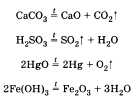 Соединение — это реакция, в результате которой из нескольких веществ получается одно. Например, сера соединяется с железом; многие кислотные и основные оксиды соединяются с водой или друг с другом: 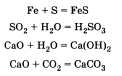 Обмен — это реакция между сложными веществами, в результате которой они обмениваются своими составными частями. Обмен наиболее характерен для ионных реакций. Например, реакция нейтрализации НСl + NaOH = NaCl + H2O; реакции между со- лями СаСl2 + Na2CO3 = CaCO3 + 2NaCl и т. д. Замещение — в неорганической химии к такому типу относят реакцию, в которую вступает сложное вещество и простое. В результате этой реакции образуется новое простое и сложное вещества. Например, железо замещает медь из ее хлорида Fe + CuCl2 = = Сu + FeCl2; натрий замещает водород из воды 2Na + 2Н20 = H2 + 2NaOH. б) В зависимости от теплового эффекта реакции подразделяются на экзотермические и эндотерми ческие. Экзотермическими называют реакции, протекающие с выделением энергии: 2Mg + 02 = 2MgO + Q Реакции, сопровождающиеся поглощением энергии, называют эндотермическими: СаСО3 = СаО + СО2 - Q Выделение или поглощение энергии может быть обозначено в уравнении реакции соответственно знаком +Q или -Q. Реакции разложения обычно протекают с поглощением энергии, а присоединения — с выделением энергии. в) Окислительно-восстановительными называют реакции, в результате которых некоторые элементы, входящие в состав исходных веществ и продуктов, меняют свои степени окисления. Например, окисление меди кислородом: 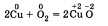 Замещение иона брома атомами хлора тоже является окислительно-восстановительной реакцией: 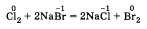 Есть реакции, идущие и без изменения степени окисления. Например, реакции ионного обмена: 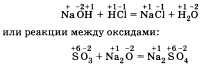 г) Каталитические и некаталитические реакции. Реакции, идущие с участием катализаторов, называются каталитическими. Не все реакции нуждаются в катализаторах, но многие без катализаторов практически идти не могут. Пример такой реакции — разложение пероксида водорода (протекает быстрее в присутствии оксида марганца (IV)): 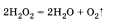 д) Необратимые и обратимые реакции. Необратимые реакции протекают до полного превращения исходных веществ в продукты: 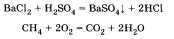 Признаками необратимости реакций в растворах является образование малодиссоциирующего вещества (осадка, газа или воды). Обратимые реакции протекают как в сторону получения продуктов реакции, так и в сторону получения исходных веществ: 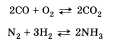 Важно отметить, что по разным признакам одна и та же реакция может быть отнесена одновременно к нескольким типам, например 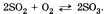 Эта реакция относится к реакциям: соединения, экзотермическим, окислительно-восстановительным, каталитическим и обратимым. Эта реакция относится к реакциям: соединения, экзотермическим, окислительно-восстановительным, каталитическим и обратимым.• Перейти к списку вопросов »
|
